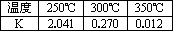��Ŀ����
CO��g��+2H2��g��
 CH3OH��g����H
CH3OH��g����H��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250��C | 300��C | 350��C |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.2mol/L����CO��ת����Ϊ
��2����100��ѹǿΪ0.1MPa�����£��ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״�����ƽ��ʱCO��ת����Ϊ50%����100��÷�Ӧ��ƽ�ⳣ��K=
| V2 |
| a2 |
| V2 |
| a2 |
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��
A������ B��������� C������CO��Ũ��
D�����ݳ���H2 E����ѹ����������� F��������״�
��4���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ��
A������CH3OH������������CO���������
B�����������ܶȲ���
C�������������ƽ��������������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��5��300��C�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ����й��������£�
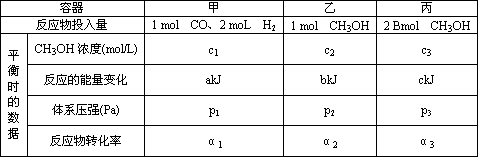
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ �� ʱ �� �� �� |
CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
��c1��c2��c3�Ĺ�ϵ������ȷ��Ϊ
A c3��2c1 B c1��c3��2c1 C c1=c2
��a��b��c�Ĺ�ϵ������ȷ��Ϊ
A c��2|��H|B a+b=|��H|C c=2b
��p1��p2��p3�Ĺ�ϵ����ȷ��Ϊ
A p1=p2 B p2��p3��2p2 C p3��2p2
��a1��a2��a3�Ĺ�ϵ���ﲻ��ȷ��Ϊ
A a1=a2 B a3��a2 C a1+a2=1��
�ڸ�����ʼ����ƽ��������ת���ʣ�����ƽ��Ũ�ȼ���ƽ�ⳣ�����Դ��ж��¶ȣ�
��2������ƽ�ⳣ���ļ��㹫ʽ���㣬����ƽ���ƶ���Ӱ���ж��ƶ�����
��3��Ҫ���CO��ת���ʣ�Ӧʹƽ��������Ӧ�����ƶ���
��4����Ӧ�ﵽƽ��ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٷ����ı䣬�ɴ�������һЩ������Ҳ���ٷ����仯��
��5���ӵ�Чƽ���ƽ���ƶ��ĽǶȷ�����
�ڴﵽƽ��ʱ���c��CO��=0.2mol/L����ת����CO�����ʵ���Ϊ2.0mol-0.2mol/L��1L=1.6mol��
����CO��ת����Ϊ
| 1.6mol |
| 2.0mol |
CO��g��+2H2��g��
 CH3OH��g��
CH3OH��g����ʼ��1mol/L 3mol/L
ת����0.8mol/L 1.6mol/L 0.8mol/L
ƽ�⣺0.2mol/L 1.4mol/L 0.8mol/L
���ԣ�k=
| 0.8mol/L |
| 0.2mol/L��(1.4mol/L)2 |
�ʴ�Ϊ��80%��250�棻
��2��
CO��g��+2H2��g��
 CH3OH��g��
CH3OH��g����ʼ��
| a |
| V |
| 2a |
| V |
ת����0.5��
| a |
| V |
| a |
| V |
| a |
| V |
ƽ�⣺0.5��
| a |
| V |
| a |
| V |
| a |
| V |
k=
| V2 |
| a2 |
���������г���a mol CH3OH��g����������Ũ������ƽ�����淴Ӧ�����ƶ����ٴδﵽ��ƽ��ʱ����ȻCO�����ʵ������࣬���������ʵ���������ҪС��CO���������������С��
�ʴ�Ϊ��
| V2 |
| a2 |
��3��A�����£�ƽ�����淴Ӧ�����ƶ���CO��ת���ʵļ�С����A����
B�����������ƽ�ⲻ�ƶ���ת���ʲ��䣬��B����
C������CO��Ũ�ȣ�CO��ת���ʵļ�С������C����
D�����ݳ���H2��ƽ��������Ӧ�����ƶ���ת��������D��ȷ��
E����ѹ����������壬ƽ�ⲻ�ƶ���ת���ʲ��䣬��E����
F��������״���ƽ��������Ӧ�����ƶ���ת��������F��ȷ��
�ʴ�Ϊ��DF��
��4��A�������Ƿ�ﵽƽ��״̬������CH3OH������������CO��������ȣ���A����
B�������Ƿ�ﵽƽ��״̬��������������䣬������������䣬����������ܶȲ��䣬��B����
C�������������ƽ�������������䣬˵����Ӧ�ﵽƽ��״̬����C��ȷ��
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯��˵����Ӧ�ﵽƽ��״̬����D��ȷ��
�ʴ�Ϊ��CD��
��5������Ϊ��Чƽ�⣬���У�c1=c2��a1=a2��a+b=|��H|��p1=p2��
�ױ���Ƚϣ��൱���ڼĻ�����ѹ�������������ƽ��������Ӧ�����ƶ���
����c3��2c1��c��2|��H|��p2��p3��2p2��a3��a2��
�ʴ�Ϊ��AC��AB��C��A��

| |||||||||||||||||||||||||||||||
CO��g��+2H2��g��
 CH3OH��g����H
CH3OH��g����H��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.2mol/L����CO��ת����Ϊ______����ʱ���¶�Ϊ______��
��2����100��ѹǿΪ0.1MPa�����£��ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״�����ƽ��ʱCO��ת����Ϊ50%����100��÷�Ӧ��ƽ�ⳣ��K=______���ú�a��V�Ĵ���ʽ��ʾ�������������ʽ������ʱ�����¶��ݻ����䣬���������г���a mol CH3OH��g����ƽ��______��������Ӧ�������淴Ӧ�����ƶ����ٴδﵽ��ƽ��ʱ��CO���������______������С�������䣩
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��______��
A������ B��������� C������CO��Ũ��
D�����ݳ���H2 E����ѹ����������� F��������״�
��4���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ��______��
A������CH3OH������������CO���������
B�����������ܶȲ���
C�������������ƽ��������������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��5��300°C�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ����й��������£�
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ �� ʱ �� �� �� | CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
��c1��c2��c3�Ĺ�ϵ������ȷ��Ϊ______
A c3��2c1 B c1��c3��2c1 C c1=c2
��a��b��c�Ĺ�ϵ������ȷ��Ϊ______
A c��2|��H|B a+b=|��H|C c=2b
��p1��p2��p3�Ĺ�ϵ����ȷ��Ϊ______
A p1=p2 B p2��p3��2p2 C p3��2p2
��a1��a2��a3�Ĺ�ϵ���ﲻ��ȷ��Ϊ______
A a1=a2 B a3��a2 C a1+a2=1��
 CH3OH(g)����H
CH3OH(g)����H