摘要:3. 例题精讲 例1今有A.B.C.D.E五种短周期元素.它们的核电荷按 C.A.D.E的顺序增大.C.D都能分别与A按原子个数比1:1或2:1形成化合物.CB可与EA2反应生成C2A与气态物质EB4.⑴写出五种元素名称A B ,C .D , E .⑵画出E的原子结构简图 .写出电子式D2A2 , EB4 .⑶比较EA2与EB4的熔点高低 < . ⑷写出D单质与CuSO4溶液反应的离子方程 . [解析]此题的关键在于分析EB4中E元素只能是ⅣA族元素C或Si.因B 的原子序数不最小.则B不可能为H元素.E的价态应为+4.B应为ⅦA族元素.且只能为F.如果无Cl元素.则原子序数比E还大.而E只能为Si.即EB4为SiF4, 从CB的化合物的形式可知C为+1价.则由C2A可知A为-2价.只能为O.能与O按原子个数比1:1或2:1形成化合物的元素只能是H或Na.
网址:http://m.1010jiajiao.com/timu_id_403986[举报]
(二)1、 C 2、AD 3、C 4、BC
5、⑴ Ar 、K 、 F 、Br 、M
⑵ H2O HCl PH3 、PH3 ⑶ Cl
6 ⑴ 79 ⑵ 略 ⑶K 、Mg 、Cl 、Se 、C
⑷HClO4、 H2SeO4 、H2CO3 、 Mg(OH)2、 KOH
7 H 、O 、Na 、S 、极性 、共价、 略、NaHSO4+NaHSO3=Na2SO4+H2O+SO2 ↑
8 ⑴Ca 、C 、S 、 ⑵CaC2+2H2O → Ca(OH)2+C2H2↑
⑶CaC2、CS2
9⑴ ⑵> ⑶NH4++H2O
⑵> ⑶NH4++H2O
 NH3?H2O+H+
NH3?H2O+H+
今有A、B、C、D、E五种短周期元素,它们的核电荷按 C、A、D、E的顺序增大。C、D都能分别与A按原子个数比1:1或2:1形成化合物。CB可与EA2反应生成C2A与气态物质EB4。
⑴写出五种元素名称A B ,C ,D , E 。
⑵画出E的原子结构简图 ,写出电子式D2A2 , EB4 。
⑶比较EA2与EB4的熔点高低 < 。
⑷写出D单质与CuSO4溶液反应的离子方程 。
查看习题详情和答案>>(1)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小.请回答:
①A2B和A2D的沸点较高者是 (填化学式),其原因是 ;
②C在元素周期表的位置是 ,C的第一电离能比D的 (填“大”或“小”);
③E的基态原子核外电子排布式为: ,E的电负性比D的 (填“大”或“小”);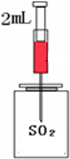
(2)某研究性学习小组在探究SO2的性质时设计了如图装置进行实验.
①将注射器中2mL品红溶液注入集满SO2气体的瓶中,进入瓶中的品红溶液褪为无色,则证明SO2具有 性;
②将注射器中2mL (填名称)溶液注入集满SO2的玻璃瓶中,看到 现象,可证明SO2是酸性氧化物;
③将注射器中2mL橙红色溴水注入集满SO2的玻璃中,溴水褪色,可证明SO2具有还原性.此反应的化学方程式为 .
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.N2H4在氧气中完全燃烧生成氮气.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是: ;又知1克液态N2H4和足量液态H2O2反应生成氮气和水蒸气时放出20.05kJ的热量,请写出此反应的热化学方程式 .
查看习题详情和答案>>
①A2B和A2D的沸点较高者是
②C在元素周期表的位置是
③E的基态原子核外电子排布式为:

(2)某研究性学习小组在探究SO2的性质时设计了如图装置进行实验.
①将注射器中2mL品红溶液注入集满SO2气体的瓶中,进入瓶中的品红溶液褪为无色,则证明SO2具有
②将注射器中2mL
③将注射器中2mL橙红色溴水注入集满SO2的玻璃中,溴水褪色,可证明SO2具有还原性.此反应的化学方程式为
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.N2H4在氧气中完全燃烧生成氮气.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是:
(1)有A、B、C、D、E五种微粒:当A微粒失去3个电子后,电子层结构与氖原子相同;B微粒得到1个电子后,电子层结构与氩原子相同;C微粒带两个单位正电荷,核电荷数为12;D微粒有18个电子,当失去2个电子时显电中性;E微粒不带电,原子核中只有一个质子.请回答下列问题.
写出微粒的符号:A
(2)6.02×1024个Na+约含
查看习题详情和答案>>
写出微粒的符号:A
Al
Al
、BCl
Cl
、CMg2+
Mg2+
、DS2-
S2-
.(2)6.02×1024个Na+约含
10
10
mol Na+,其质量为230
230
g;4.5molCH4约含有2.709×1024(或4.5NA),
2.709×1024(或4.5NA),
个CH4,其质量为72
72
g.
(1)有A、B、C、D、E五种微粒:当A微粒失去3个电子后,电子层结构与氖原子相同;B微粒得到1个电子后,电子层结构与氩原子相同;C微粒带两个单位正电荷,核电荷数为12;D微粒有18个电子,当失去2个电子时显电中性;E微粒不带电,原子核中只有一个质子.请回答下列问题.
写出微粒的符号:A______、B______、C______、D______.
(2)6.02×1024个Na+约含______mol Na+,其质量为______g;4.5molCH4约含有______个CH4,其质量为______g.
查看习题详情和答案>>
写出微粒的符号:A______、B______、C______、D______.
(2)6.02×1024个Na+约含______mol Na+,其质量为______g;4.5molCH4约含有______个CH4,其质量为______g.
查看习题详情和答案>>
今有A、B、C、D、E、F六种元素,其中A元素是1826年一位法国青年科学家发现的.他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若进一步提取,可得一种红棕色液体,有刺鼻的气味.B、C、D、E、F为短周期元素.D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等.D原子的最内电子层上电子数是B原子核外电子总数的2倍.E+和F2+都比A离子少26个电子.根据你的推断回答下列问题:
(1)六种元素分别为:A
(2)由上述六中元素中的某元素的单质与另两种元素的化合物反应生成两种酸的化学方程是
(3)写出往剩余的副产物苦卤中通入氯气后发现溶液颜色变深的离子方程式:
(4)由上述元素可形成四种具有漂白作用的物质,请写出其中漂白原理与另三种不同的物质的化学式:
查看习题详情和答案>>
(1)六种元素分别为:A
Br
Br
; DS
S
;ENa
Na
;FMg
Mg
.(2)由上述六中元素中的某元素的单质与另两种元素的化合物反应生成两种酸的化学方程是
Br2+H2O═HBr+HBrO
Br2+H2O═HBr+HBrO
.(3)写出往剩余的副产物苦卤中通入氯气后发现溶液颜色变深的离子方程式:
Cl2+2Br-═2Cl-+Br2
Cl2+2Br-═2Cl-+Br2
;该反应能发生的理由是Cl2的氧化性强
Cl2的氧化性强
.(4)由上述元素可形成四种具有漂白作用的物质,请写出其中漂白原理与另三种不同的物质的化学式:
SO2
SO2
.