摘要:[解析]本题如使用Cl原子守恒的方法可大大简化解题步骤.由题意.反应后溶液为KCl溶液.其中的Cl-来自盐酸.所以所得KCl固体的物质的量与HCl的物质的量相等.即为0.001bmol.质量为0.0745bg.如果解题时使用ag这个数据.也能获得答案.此时答案中也会含有b.请读者自行解答.本题正确答案为C.
网址:http://m.1010jiajiao.com/timu_id_403858[举报]
I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 ;
(2)液氨是富氢物质,是氢能的理想载体,利用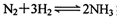 实现储氢和输氢。下列说法正确的是
;
实现储氢和输氢。下列说法正确的是
;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是 ;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
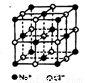
(1)设氯化钠晶体中Na+与跟它最近邻的Cl—之间的距离为r,则该Na+与跟它次近邻的C1—个数为 ,该Na+与跟它次近邻的Cl—之间的距离为 ;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl—的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为 ;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为 。
查看习题详情和答案>>
氯气在生产生活中应用广泛.
(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域.请写出该化学反应的化学方程式
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:
①步骤I中,试剂甲必须具有的性质是
a.氧化性b.还原性c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,该反应的离子方程式为
查看习题详情和答案>>
(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域.请写出该化学反应的化学方程式
2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl
2MnSO4+Cl2+3H2O═Mn2O3+2H2SO4+2HCl
.(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2.1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如图所示:

①步骤I中,试剂甲必须具有的性质是
b
b
(填序号).a.氧化性b.还原性c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050mol MnO2时,消耗0.10mol?L-1 的NaClO3溶液200mL,该反应的离子方程式为
2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+
2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+
.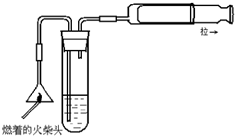 火柴头中含有硫和氯元素,用适当的方法可加以检验,回答下列问题:
火柴头中含有硫和氯元素,用适当的方法可加以检验,回答下列问题:(1)如图是检验火柴头中含有硫元素的实验装置示意图.图中试管中应装有
酸性KMnO4溶液
酸性KMnO4溶液
溶液,拉动注射器活塞时,若观察到紫色褪去
紫色褪去
现象证明火柴头燃烧时产生了SO2
SO2
.(2)原火柴头中的氯元素是以KClO3的形式存在的,其作用是助燃剂,当火柴头燃烧后其中的氯元素是以
Cl-(或氯化物)
Cl-(或氯化物)
物质的形式存在,检验的方法将燃烧后的火柴头用少量蒸馏水浸泡,片刻后取少量溶液于试管中,向溶液中滴加AgNO3溶液和稀硝酸,有白色沉淀生成,说明氯元素是以氯离子形式存在
将燃烧后的火柴头用少量蒸馏水浸泡,片刻后取少量溶液于试管中,向溶液中滴加AgNO3溶液和稀硝酸,有白色沉淀生成,说明氯元素是以氯离子形式存在
. (选做题)
(选做题)按下列要求填空:
(1)将2.8gFe加入稀盐酸中,铁完全反应,在标准状况下,生成H2的体积为
1.12
1.12
L.(2)实验室需配制480mL1mol/LNa2CO3溶液,需要称量Na2CO3的质量是
53.0
53.0
g(精确到0.1g).(3)有O2与HCl组成的混合气体,其质量比是32:73,则O2与HCl的体积比是
1:2
1:2
.(4)相同质量的S02和S03中,所含原子个数比是
15:16
15:16
.(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是
| 45V |
| 28 |
| 45V |
| 28 |
(6)A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
试确定A、B、C、D、X各代表何种溶液.
A:
NaOH
NaOH
,B:NaNO3
NaNO3
,C:Ba(NO3)2
Ba(NO3)2
,D:HNO3
HNO3
,X:MgSO4
MgSO4
.化学中用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.但类比是相对的,如根据2Na2O2+2CO2=2Na2CO3+O2类推:2Na2O2+2SO2=2Na2SO3+O2是错误的,应该为:Na2O2+SO2=Na2SO4.
(1)下列各组类比中正确的是 (填序号);
A.由NH4Cl
NH3↑+HCl↑ 推测:NH4I
NH3↑+HI↑
B.由2Fe+3Cl2═2FeCl3 推测:2Fe+3Br2═2FeBr3
C.由Na2SO3+2HCl=2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3═2NaNO3+H2O+SO2↑
D.由I2易溶于KI溶液 推测:Cl2易溶于NaCl溶液
(2)由氧化铁与盐酸反应生成氯化铁和水,应用有关知识推断写出氧化亚铁与稀硝酸反应的化学方程式 ;
(3)电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-的化学方程式为:
CN-+ ClO-+ H2O= HCO3-+ N2+ Cl-,
配平该反应的化学方程式,在空格填上系数;
(4)(CN)2被称为拟卤素,它的阴离子CN-作为配体形成的配合物有重要用途.HgCl2和Hg(CN)2反应可制得Hg2Cl2 和(CN)2,该反应的氧化产物是 .
查看习题详情和答案>>
(1)下列各组类比中正确的是
A.由NH4Cl
| ||
| ||
B.由2Fe+3Cl2═2FeCl3 推测:2Fe+3Br2═2FeBr3
C.由Na2SO3+2HCl=2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3═2NaNO3+H2O+SO2↑
D.由I2易溶于KI溶液 推测:Cl2易溶于NaCl溶液
(2)由氧化铁与盐酸反应生成氯化铁和水,应用有关知识推断写出氧化亚铁与稀硝酸反应的化学方程式
(3)电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-的化学方程式为:
配平该反应的化学方程式,在空格填上系数;
(4)(CN)2被称为拟卤素,它的阴离子CN-作为配体形成的配合物有重要用途.HgCl2和Hg(CN)2反应可制得Hg2Cl2 和(CN)2,该反应的氧化产物是