题目内容
已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:![]() +
+![]() +H+
+H+![]() CO2↑+Mn2++H2O;
CO2↑+Mn2++H2O;![]() +Fe2++H+
+Fe2++H+![]() Fe3++Mn2++H2O。
Fe3++Mn2++H2O。
现称取草酸亚铁(FeC2O4)样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再将其溶于稀硫酸,然后用0.200 mol·L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
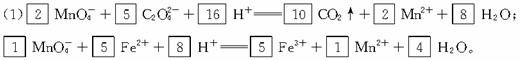
(1)试分别配平下列两个离子反应式。
□![]() +□
+□![]() +□H+
+□H+![]() □CO2↑+□Mn2++□H2O;
□CO2↑+□Mn2++□H2O;
□![]() +□Fe2++□H+
+□Fe2++□H+![]() □Fe3++□Mn2++□H2O。
□Fe3++□Mn2++□H2O。
(2)求样品中草酸亚铁的质量分数。
(2)80.0%
解析:该题为氧化还原方程式的配平及有关计算。
(1)![]() 中C为+3价,
中C为+3价,![]() 中Mn为+7价,由得失电子数相等配平即可。
中Mn为+7价,由得失电子数相等配平即可。
(2)由反应方程式可推出关系式:
3KMnO4 — 5FeC2O4
3 5
0.0334 L×0.200 mol·L-1 n(FeC2O4)
w(FeC2O4)=![]() ×100%
×100%
= ×100%=80.0%
×100%=80.0%

练习册系列答案
相关题目
 根据如图回答问题:
根据如图回答问题:
 SO2、NOx是重要的空气污染源,必须经过处理后才能排放.一种工业尾气含SO2、O2、N2和CO2,某同学采用图示装置来测定该尾气中SO2的含量.
SO2、NOx是重要的空气污染源,必须经过处理后才能排放.一种工业尾气含SO2、O2、N2和CO2,某同学采用图示装置来测定该尾气中SO2的含量.