摘要:22.氮是地球上含量丰富的一种元素.氮及其化合拖把在工农业生产.生活中有着重要作用.请回答:
网址:http://m.1010jiajiao.com/timu_id_386626[举报]
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
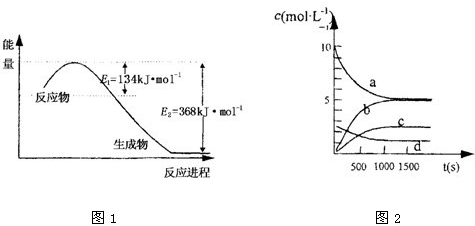
(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式
又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①写出该反应的平衡常数表达式:K=
,已知:K300℃>K350℃,则该反应是
②反应达到平衡后,NO2的转化率为
③如图2中表示N2O5 的浓度的变化曲线是
查看习题详情和答案>>

(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
;又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=
-760.3kJ?mol-1
-760.3kJ?mol-1
;(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
| c2(N2O5) |
| c4( NO2)c(O2) |
| c2(N2O5) |
| c4( NO2)c(O2) |
放
放
热反应②反应达到平衡后,NO2的转化率为
49.6%
49.6%
,此时若再通入一定量氮气,则NO2的转化率将不变
不变
(填“增大”、“减小”、“不变”);③如图2中表示N2O5 的浓度的变化曲线是
c
c
,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L?s)
1.51×10-3mol/(L?s)
. 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应.10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为
10%
10%
.若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议(写出一条即可)增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨)
增大反应物浓度(或降低温度,或增大压强,或及时转移走生成的氨)
.(2)如图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.(3)在容积恒定的密闭容器中,进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
②试判断K1
>
>
K2(填写“>”“=”或“<”);③NH3(g)燃烧的方程式为4NH3(g)+7O2(g)═4NO2(g)+6H2O(l),已知:
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.8kJ/mol
N2(g)+3H2(g)═2NH3(g)△H=-92.0kJ/mol
请计算NH3(g)的燃烧热
282.8kJ/mol
282.8kJ/mol
. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.(2)在
①
①
中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:| t/K | 298 | 398 | 498 | … |
| K/ | 4.1×106 | K1 | K2 | … |
①写出该反应的平衡常数表达式:K=
c2(NH3)/[c(N2)×c3(H2)]
c2(NH3)/[c(N2)×c3(H2)]
②试比较K1、K2的大小,K1
>
>
K2(填写“>”“=”或“<”)③下列各项能作为判断该反应达到化学平衡状态的依据的是
C
C
(填序号字母,多选倒扣分!).A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
④400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数的值为
N2(g)+3H2(g)的化学平衡常数的值为2
2
.当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的υ(N2)(正)
>
>
υ(N2)(逆)(填写“>”、“=”或“<”).氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.

(1)根据右侧能量变化示意图1,请写出NO2和CO反应的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,
其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K=
.
.
②试判断K1
③下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
,则N2的转化率a(N2)=
(5)实验室制取氨气的化学反应方程式
查看习题详情和答案>>

(1)根据右侧能量变化示意图1,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234KJ/mol
NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234KJ/mol
.(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
②试判断K1
>
>
K2(填写“>”,“=”或“<”)③下列各项能说明该反应已达到平衡状态的是
c
c
(填字母)a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是
cd
cd
.a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的
| 7 |
| 8 |
25%
25%
,以NH3表示该过程的反应速率v(NH3)=0.05mol/(L?min)
0.05mol/(L?min)
.(5)实验室制取氨气的化学反应方程式
2NH4Cl+Ca(OH)2
2 NH3↑+CaCl2+2H2O
| ||
2NH4Cl+Ca(OH)2
2 NH3↑+CaCl2+2H2O
.
| ||
氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途.
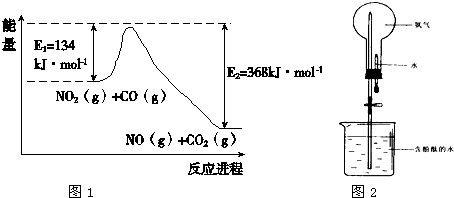
(1)根据图1能量变化示意图:写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表,试判断K1
(3)下列各项能说明该反应达到平衡状态的是
a.v正(H2)=3v逆(N2)
b.容器内压强保持不变
c.容器中混合气体的密度保持不变
d.N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用如图2实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红.请回答:
①用化学用语说明所得氨水能使酚酞变红的原因
②25℃时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为
a.c(Cl-)>c(NH4+) b.c(Cl-)﹦c(NH4+)
c.c(Cl-)<c(NH4+) d.无法判断.
查看习题详情和答案>>

(1)根据图1能量变化示意图:写出CO和NO2反应生成NO和CO2的热化学方程式
CO(g)+NO2(g)═CO2(g)+NO(g)△H=-234kJ/mol
CO(g)+NO2(g)═CO2(g)+NO(g)△H=-234kJ/mol
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表,试判断K1
>
>
K2(填“>”、“=”或“<”)| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
ab
ab
(填字母序号)a.v正(H2)=3v逆(N2)
b.容器内压强保持不变
c.容器中混合气体的密度保持不变
d.N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用如图2实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红.请回答:
①用化学用语说明所得氨水能使酚酞变红的原因
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.②25℃时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为
b
b
(填字母序号)a.c(Cl-)>c(NH4+) b.c(Cl-)﹦c(NH4+)
c.c(Cl-)<c(NH4+) d.无法判断.