网址:http://m.1010jiajiao.com/timu_id_383715[举报]
一、选择题(本题包括
1.D 2.C 3.C 4.D 5.C 6.C 7.D 8.D 9.C l0.C
l1.B 12.C 13.C 14.C 15.D 16.C l 7.B l 8.D 19.B 20.A
二、本题包括1小题,共12分。
21.(12分)
(1)B中装无水硫酸铜,检验水蒸气;C中装澄清的石灰水,检验二氧化碳;(每空1分)
(2)验纯后点燃E处的气体,火焰呈蓝色。(2分,不答“验纯”扣1分)
(3)点燃前应验纯;CO有毒,实验要通风;加热时要均匀受热等。(2分)
(4)挥发出来的草酸蒸气与石灰水反应生成了草酸钙沉淀,会干扰CO2的检验(2分)
在装置B和C装置间增加一个装有水(或烧碱溶液)的洗气装置(2分)
三、本题包括3小题,共38分。
22.(每空2分,共12分)
(2)>
(3)A1 +3NH3?H2O=Al(OH)3↓ +3NH
+3NH3?H2O=Al(OH)3↓ +3NH
(4)NH4Al(SO4)2
(5)336
23.(每空2分,共l 2分)
(1)A:Si B:Mg
(2)抑制氯化镁水解
(3)①Si+2NaOH+H2O=Na2SiO3+2H2↑
③ Mg2Si+4HCl=SiH4↑+2MgCl2
24.(每空2分,共14分)
(1)
(2)O2+2CO2+4e =2CO
=2CO
(3)CO2 负极反应产物
②
③ 560
四、本题包括l小题,共l0分。
25.(1)Fe+H2SO4=FeSO4+H2↑(2分)
FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2?6H2O(2分)
(2)解:设生成(NH4)2Fe(SO4)2?6H2O的物质的量为x mol。由上述方程式知:
H2SO4~FeSO4~(NH4)2Fe(SO4)2?6H2 O
1 mol l mol
15×3×10 mol x
mol
mol x
mol
x=0.045
生成(NH4)2Fe(SO4)2?6H2O的质量为:0.045 mol×
(3)① 5、1、8、1、5、4 H2O(2分)
② 83.33%。(2分)
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4?2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | - |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g?cm-3) | 1.900 | 1.650 |
①草酸在100℃时开始升华,157℃时大量升华,并开始分解.
②草酸钙不溶于水.
③草酸蒸气能使澄清石灰水变浑浊.
④草酸蒸气在低温下可冷凝为固体.
根据上述材料提供的信息,回答下列问题:
【提出猜想】
(猜想一)根据草酸晶体的组成对其分解产物进行猜想
设计方案:
(1)该小组同学猜想其产物为CO、CO2和H2O,请用下列装置组成一套探究实验装置(草酸晶体分解装置略,装置可重复使用,连接导管略去).
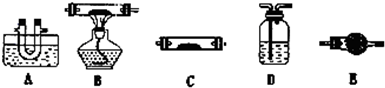
A中水槽装冰水混合物、B中装氧化铜、C中装无水硫酸铜,D中装澄清石灰水、E中装碱石灰
请回答下列问题:
①装置的连接顺序为:A→
②检验产物中CO的实验现象是
③整套装置是否存在不合理之处,
(猜想二)乙二酸具有弱酸性
设计方案:
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
(猜想三)乙二酸具有还原性
设计方案:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性.配平该反应的离子方程式:
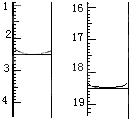
(4)利用上述原理可定量测定某草酸晶体样品(含有H2C2O4?2H2O及其它一些杂质)中H2C2O4?2H2O的含量.
方法是:称取该样品0.12g,加适量水完全溶解,然后用0.020mol?L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示(单位:mL),则该草酸晶体样品中H2C2O4?2H2O的质量分数为
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,

据此,乙二酸分解的产物为
| ||
| ||
(4)该小组同学将2.52g草酸晶体(H2C2O4?2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
(1)探究草酸的酸性
25℃H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是
A.H2C2O4+CO32-=HCO3-+HC2O4-B.HC2O4-+CO32-=HCO3-+C2O42-
C.2C2O42-+CO2+H2O=2HC2O4-+CO32-D.H2C2O4+CO32-+=C2O42-+H2O+CO2↑
(2)探究草酸分解产物

①实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用:
②写出H2C2O4分解的化学方程式:
| ||
| ||
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入4mL 0.0lmol/LKMnO4酸性溶液和2mL0.1moL/L H2C2O4溶液,再向乙试管中加入一粒黄豆大的MnSO4固体,摇匀.填写下表:
| 反应现象 | 两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快 两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快 |
| 实验结论 | MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快 MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快 |
| 试管中发生反应的离子方程式 | 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O |
实验步骤:准确称取2.0g Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中.再向瓶中加入足量稀H2SO4,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
①高锰酸钾溶液应装在
②滴定至终点时的实验现象是:
③Na2C2O4的纯度是:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红.据此回答:
①上述装置中,D的作用是
②乙二酸分解的化学方程式为
| ||
| ||
(4)该小组同学将2.52g草酸晶体(H2C2O4?2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC—COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸)为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_______________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
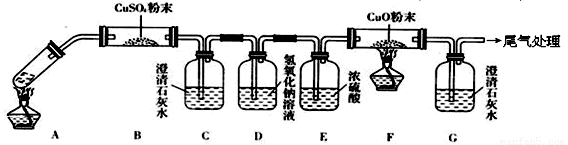
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。
乙二酸分解的化学方程式为____________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________________。(用文字简单表述)
(5)以上溶液中各离子的浓度由大到小的顺序为: _____________________;(用离子符号表示)
查看习题详情和答案>>



