摘要:.下列物质:①氯化钠溶液,②氯化铵固体:③铜,④石墨,⑤熔融NaOH,⑥稀硫酸,⑺醋酸, 属于强电解质的是 能导电的是 .醋酸的电离方程式为 .
网址:http://m.1010jiajiao.com/timu_id_383273[举报]
下列物质属于强电解质且该状态下能导电的是:( )
(1)氯化钠溶液;(2)氯化铵固体;(3)铜;(4)石墨;
(5)熔融NaOH; (6)稀硫酸; (7)乙酸;
| A.(1)(2)(5)(6) | B.(5) |
| C.(2)(5) | D.(1)(3)(4)(5)(6) |
|
下列物质属于强电解质且该状态下能导电的是: (1)氯化钠溶液; (2)氯化铵固体; (3)铜; (4)石墨; (5)熔融NaOH; (6)稀硫酸; (7)乙酸; | |
| [ ] | |
A. |
(1)(2)(5)(6) |
B. |
(5) |
C. |
(2)(5) |
D. |
(1)(3)(4)(5)(6) |
物质的加热是中学化学实验的重要基本操作,加热方式常用的有三类:Ⅰ.直接用酒精灯加热 Ⅱ.通过石棉网用酒精灯加热 Ⅲ.通过水浴加热。
以下七个化学实验通常均需加热:
①实验室用氯化钠固体和浓硫酸制取硫酸钠和氯化氢
②用蒸发皿蒸发食盐溶液制取氯化钠晶体
③氯化铵与碱石灰制取氨气
④苯与浓硝酸和浓硫酸反应制取硝基苯
⑤苯酚与福尔马林制取酚醛树脂
⑥乙醛溶液与银氨溶液的银镜反应
⑦葡萄糖溶液与新制氢氧化铜悬浊液反应
请将上述实验填写在下列各栏中(填编号,7个实验不重复)
(1)直接加热的有________;
(2)通过石棉网加热的有________;
(3)通过水浴加热的有________。
查看习题详情和答案>>
铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:
C10Hl2FeN2NaO8·3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇。l%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下
C10Hl2FeN2NaO8·3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇。l%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下

实验室制备NaFeEDTA·3H2O步骤如下:
①把0.4g(0.0lmol)NaOH溶于l0mL蒸馏水,然后再加入3.8g(0.01mo1)Na2H2EDTA·2H2O,把溶液微热,直至固体完全溶解。
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3·6H2O。称取2.5g(0.009mol)FeCl3·6H2O溶予5mL,蒸馏水中(并加l滴盐酸)。
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出。
⑤冷却、减压过滤,先用冰水洗涤樗用乙醇洗涤。
⑥将固体凉干,称得制得的淡黄色粉末2.8g
试回答下列问题
(1)在步骤①中,须加入过量的碱,是因为_________________。
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是___________________________;加显色利后分别发生反应的离子方程式为_______________________;_________________________。
(3)步骤⑤中用冰水和乙醇洗涤的目的是,_________________,_________________。
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:__________________________________。
(5)检验某品牌酱油中是否加有NaFeEDTA·3H2O,先取20mL酱油加入10rnL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是_________________(写化学式)。
(6)本次实验的NaFeEDTA·3H2O的实际产率为:_________________。
查看习题详情和答案>>
①把0.4g(0.0lmol)NaOH溶于l0mL蒸馏水,然后再加入3.8g(0.01mo1)Na2H2EDTA·2H2O,把溶液微热,直至固体完全溶解。
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3·6H2O。称取2.5g(0.009mol)FeCl3·6H2O溶予5mL,蒸馏水中(并加l滴盐酸)。
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出。
⑤冷却、减压过滤,先用冰水洗涤樗用乙醇洗涤。
⑥将固体凉干,称得制得的淡黄色粉末2.8g
试回答下列问题
(1)在步骤①中,须加入过量的碱,是因为_________________。
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是___________________________;加显色利后分别发生反应的离子方程式为_______________________;_________________________。
(3)步骤⑤中用冰水和乙醇洗涤的目的是,_________________,_________________。
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:__________________________________。
(5)检验某品牌酱油中是否加有NaFeEDTA·3H2O,先取20mL酱油加入10rnL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是_________________(写化学式)。
(6)本次实验的NaFeEDTA·3H2O的实际产率为:_________________。
B.铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇.1%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下:

实验室制备NaFeEDTA?3H2O步骤如下:
①把0.4g(0.01mol)NaOH溶于10mL蒸馏水,然后再加入3.8g(0.01mol)Na2H2EDTA?2H2O,把溶液微热,直至固体完全溶解.
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3?6H2O.称取2.5g(0.009mol)FeCl3?6H2O溶于5mL,蒸馏水中(并加1滴盐酸).
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出.
⑤冷却、采用右图装置减压过滤,先用冰水洗涤再用乙醇洗涤.
⑥将固体凉干,称得制得的淡黄色粉末2.8g.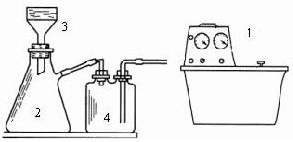
试回答下列问题
(1)在步骤①中,不能加入过量的碱,是因为 .
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是 ;加显色剂后分别发生反应的离子方程式为 ; .
(3)步骤⑤中用冰水和乙醇洗涤的目的是, , .
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是: .
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是 (写化学式).
(6)本次实验的NaFeEDTA?3H2O的实际产率为: .
查看习题详情和答案>>

实验室制备NaFeEDTA?3H2O步骤如下:
①把0.4g(0.01mol)NaOH溶于10mL蒸馏水,然后再加入3.8g(0.01mol)Na2H2EDTA?2H2O,把溶液微热,直至固体完全溶解.
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3?6H2O.称取2.5g(0.009mol)FeCl3?6H2O溶于5mL,蒸馏水中(并加1滴盐酸).
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出.
⑤冷却、采用右图装置减压过滤,先用冰水洗涤再用乙醇洗涤.
⑥将固体凉干,称得制得的淡黄色粉末2.8g.

试回答下列问题
(1)在步骤①中,不能加入过量的碱,是因为
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是
(3)步骤⑤中用冰水和乙醇洗涤的目的是,
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是
(6)本次实验的NaFeEDTA?3H2O的实际产率为: