摘要: ⑴Mg 直线形 ⑵将D溶液在HCl气流中蒸干⑶4NH3+5O2=4NO+6H2O ⑷2NH4++2e-===2NH3↑+H2↑
网址:http://m.1010jiajiao.com/timu_id_369019[举报]
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.回答下列问题:
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分子的立体结构分别是
(3)Q的元素符号是
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
查看习题详情和答案>>
(1)X、Y的元素符号依次为
S
S
、C
C
;?(2)XZ2与YZ2分子的立体结构分别是
V形
V形
和直线形
直线形
,相同条件下两者在水中的溶解度较大的是SO2
SO2
(写分子式),理由是SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子
SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子
;(3)Q的元素符号是
Cr
Cr
,它属于第四
四
周期,它的核外电子排布式为1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,在形成化合物时它的最高化合价为+6
+6
;(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键
F-H…F、F-H…O、O-H…F、O-H…O
F-H…F、F-H…O、O-H…F、O-H…O
.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分子的立体结构分别是
(3)Q的元素符号是
查看习题详情和答案>>
(1)X、Y的元素符号依次为
S
S
、C
C
;(2)XZ2与YZ2分子的立体结构分别是
V形
V形
和直线形
直线形
,相同条件下两者在水中的溶解度较大的是SO2
SO2
(写分子式),理由是SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子
SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子
;(3)Q的元素符号是
Cr
Cr
,它属于第四
四
周期,它的核外电子排布式为1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,在形成化合物时它的最高化合价为+6
+6
. 由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.(1)写出Fe2+的核外电子排布式
(2)下列说法正确的是
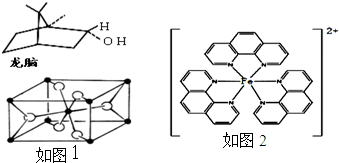
a.H2S、O3分子都是直线形.b.BF3和NH3都是含有极性键的非极性分子.c.CO2、HCN分子的结构式分别是:O=C=O、H-C≡N.d.一种双环单萜龙脑(如图1)分子式为C10H16O
(3)NO是人体中的信号分子,有关说法正确的
a.原子半径N大于O b.非金属性O大于N c.NO+的结构为:N≡O+ d.NO形成的晶体是分子晶体
(4)TiO2的天然晶体中,最稳定的一种晶体结构如右图,白球表示:
(5)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,
实验室测定铁的含量可用配位剂邻二氮菲(
 ),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有
),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有(6)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构:
(2009?南京二模)选做题,本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题作答,并把所选题目对应字母后的方框涂黑.若两题都作答,将按A题评分.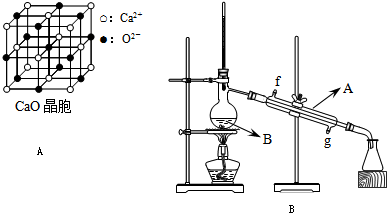
A.可以由下列反应合成三聚氰胺:
CaO+3C
CaC2+CO↑ CaC2+N2
CaCN2+C↑ CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
(2)尿素分子中C原子采取
 ,其中碳氧原子之间的共价键是
,其中碳氧原子之间的共价键是
A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(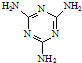 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 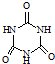 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过
(4)CaO晶胞如图A所示,CaO晶体中Ca2+的配位数为
B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率
查看习题详情和答案>>

A.可以由下列反应合成三聚氰胺:
CaO+3C
| ||
| ||
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
1s22s22p63s23p63d104s2或[Ar]3d104s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
.CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2
CO2
(填化学式),由此可以推知CN22-离子的空间构型为直线形
直线形
.(2)尿素分子中C原子采取
sp2
sp2
杂化.尿素分子的结构简式是

C
C
(填字母)A.2个σ键 B.2个π键 C.1个σ键、1个π键
(3)三聚氰胺(
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(  )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键
分子间氢键
结合,在肾脏内易形成结石.(4)CaO晶胞如图A所示,CaO晶体中Ca2+的配位数为
6
6
.CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ/mol、NaCl 786kJ/mol.导致两者晶格能差异的主要原因是CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量
.B.实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的物理性质如下表.请回答有关问题.
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式:
CH3CH2CH2CH2OCH2CH2CH2CH3
CH3CH2CH2CH2OCH2CH2CH2CH3
、CH2=CHCH2CH3
CH2=CHCH2CH3
.(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:
用分水器及时移走反应生成的水,减少生成物的浓度;
用分水器及时移走反应生成的水,减少生成物的浓度;
、使用过量醋酸,提高正丁醇的转化率
使用过量醋酸,提高正丁醇的转化率
.Ⅱ.乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是
C
C
(填字母).A.①②③④B.③①④②C.①④①③②D.④①③②③
(2)将酯层采用如图B所示装置蒸馏.
1.出图中仪器A的名称
冷凝管
冷凝管
.冷却水从下
下
口进入(填字母).2.②蒸馏收集乙酸正丁酯产品时,应将温度控制在
126.1℃
126.1℃
左右.Ⅲ.计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率
79.4%
79.4%
.【化学-选修物质结构与性质】
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
(2)Q的元素符号是
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5, 其电子式为
其电子式为
 ;其晶体的最小结构单元如图所示经实验测得CA5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为
;其晶体的最小结构单元如图所示经实验测得CA5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为
cm.
查看习题详情和答案>>
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素.
请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是
V形
V形
和直线形
直线形
,相同条件下两者在水中的溶解度较大的是SO2
SO2
(写分子式),理由是因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
;(2)Q的元素符号是
Cr
Cr
,它的核外电子排布式为1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,在形成化合物时它的最高化合价为+6
+6
;(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键
F-H…FF-H…O O-H…F O-H…O
F-H…FF-H…O O-H…F O-H…O
.(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,
 其电子式为
其电子式为

| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||