摘要:(4) 移动(填“向逆反应方向 .“向正反应方向 或“不 ).化学平衡常数K (填“增大 .“减小 或“不变 ).(5) 五.
网址:http://m.1010jiajiao.com/timu_id_354399[举报]
可逆反应C(固)+H2O(气)?CO(气)+H2(气)△H>0 在一定条件下达到平衡,改变下列条件,正、逆反应速率各怎样变化 (填写变大、变小或不变)?化学平衡怎样移动 (向左、向右或不变)?
(1)投入焦炭粉末;(2)增加CO;(3)降温;(4)加压(减小体积);(5)使用催化剂
查看习题详情和答案>>
(1)投入焦炭粉末;(2)增加CO;(3)降温;(4)加压(减小体积);(5)使用催化剂
| (1) | (2) | (3) | (4) | (5) | |
| 正反应速率 | |||||
| 逆反应速率 | |||||
| 平衡移动方向 |
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题:(1)该反应是
放热
放热
反应(填“吸热”“放热”);△H<
<
(填“<0”或“>0”).(2)当反应达到平衡时,升高温度,A的转化率
减小
减小
(填“增大”“减小”“不变”),原因是该反应正反应为放热反应,升高温度使平衡向逆反应方向移动
该反应正反应为放热反应,升高温度使平衡向逆反应方向移动
.(3)反应体系中加入催化剂对反应热是否有影响?
不影响,催化剂不改变平衡的移动
不影响,催化剂不改变平衡的移动
.(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小”、“不变”).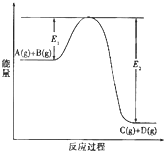 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.(1)该反应是
(2)当反应达到平衡时,升高温度,正反应速率变化是
(3)在该反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
反应:N2(g)+3H2(g) 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
(1)图中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)下图是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可。曲线上必须标出N2、H2、NH3)。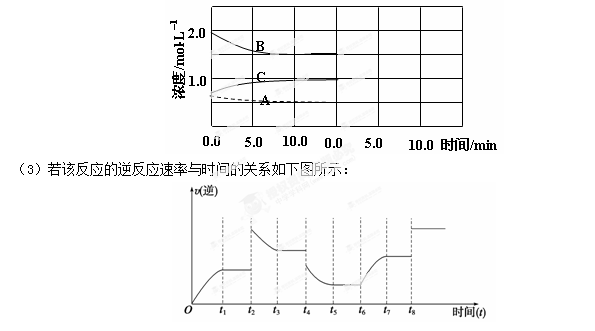
反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”……?等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动。
 C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
C(g)+D(g),其中a为正整数。反应过程中,当其他条件不