网址:http://m.1010jiajiao.com/timu_id_344074[举报]
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1.C 2.B 3.B 4.B 5.D 6.D 7.B 8.A 9.B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
10.C 11.C 12.BC 13.D 14.AC 15.AD 16.AB 17.D 18.BD
三、(本题包括3小题,共32分)
19.(10分)
(1)①-----化学.files/image569.gif) [或
[或-----化学.files/image569.gif) 和
和-----化学.files/image572.gif) ](2分)
](2分)
②将-----化学.files/image574.gif) 晶体在干燥的
晶体在干燥的-----化学.files/image194.gif) 气流中加热(1分)
气流中加热(1分)
②关闭-----化学.files/image579.gif) ,打开
,打开-----化学.files/image581.gif) ,通入足量空气后,再打开
,通入足量空气后,再打开-----化学.files/image579.gif) ,关闭
,关闭-----化学.files/image581.gif) (2分)
(2分)
③D中碱石灰会吸收空气中水蒸气和-----化学.files/image078.gif) 等酸性气体,产生误差,测得
等酸性气体,产生误差,测得-----化学.files/image585.gif) 偏大,
偏大,-----化学.files/image587.gif) 偏小(2分)
偏小(2分)
④-----化学.files/image589.gif) (2分)
(2分)
20.(12分)
(2) -----化学.files/image096.gif) (1分) (3)②③(2分)
(1分) (3)②③(2分)
(5)①-----化学.files/image592.gif) (1分)
(1分)
-----化学.files/image594.gif) (血红色)(1分)
(血红色)(1分)
②-----化学.files/image279.gif) 氧化
氧化-----化学.files/image351.gif) ,使平衡
,使平衡-----化学.files/image598.gif)
-----化学.files/image306.gif)
-----化学.files/image600.gif) 左移,红色消失(2分)
左移,红色消失(2分)
③取一支试管,加入少量-----化学.files/image602.gif) 溶液和几滴
溶液和几滴-----化学.files/image604.gif) 溶液,溶液变为红色,再加入适量
溶液,溶液变为红色,再加入适量-----化学.files/image279.gif) 振荡,产生气泡,红色褪去,说明是
振荡,产生气泡,红色褪去,说明是-----化学.files/image279.gif) 氧化了溶液的
氧化了溶液的-----化学.files/image351.gif) 离子使溶液褪色(2分)
离子使溶液褪色(2分)
说明:(1)加入-----化学.files/image279.gif) 与
与-----化学.files/image604.gif) 溶液的顺序可以互换;(2)上面离子方程式的
溶液的顺序可以互换;(2)上面离子方程式的-----化学.files/image351.gif) 写成
写成-----化学.files/image604.gif) 不扣分;(3)简答中要有仪器、试剂、操作、现象、结论共5个要点,现象“产生气泡”和“红色褪去”2点不能少;(4)若把“溶液褪色”答成“溶液变为黄色或棕色”照样给分。
不扣分;(3)简答中要有仪器、试剂、操作、现象、结论共5个要点,现象“产生气泡”和“红色褪去”2点不能少;(4)若把“溶液褪色”答成“溶液变为黄色或棕色”照样给分。
(6)第六步:还原性(1分) -----化学.files/image096.gif) 在人体血红蛋白中起传送
在人体血红蛋白中起传送-----化学.files/image300.gif) 的作用,
的作用,-----化学.files/image357.gif) 没有此功能,服用
没有此功能,服用-----化学.files/image611.gif) 可防止药品的
可防止药品的-----化学.files/image096.gif) 氧化成
氧化成-----化学.files/image357.gif) (或答成人体只能吸收
(或答成人体只能吸收-----化学.files/image096.gif) ,
,-----化学.files/image096.gif) 在人体血红蛋白中起传送
在人体血红蛋白中起传送-----化学.files/image300.gif) 的作用,服用
的作用,服用-----化学.files/image611.gif) 可防止药品的
可防止药品的-----化学.files/image096.gif) 氧化成
氧化成-----化学.files/image357.gif) )(2分)
)(2分)
21.(10分)
(1) -----化学.files/image046.gif) 、
、-----化学.files/image362.gif) (2)
(2) -----化学.files/image046.gif) 、
、-----化学.files/image364.gif) (3)
(3) -----化学.files/image364.gif) 、
、-----化学.files/image362.gif) (每空1分,全对4分,可以互换)
(每空1分,全对4分,可以互换)
(5) -----化学.files/image368.gif) (1分)
(1分) -----化学.files/image572.gif) (1分)
(1分)
(6) -----化学.files/image618.gif)
-----化学.files/image620.gif) (2分)
(2分)
(7)将沉淀A、F洗涤,小心干燥,分别称量(2分)
四、(本题包括3小题,共37分)
22.(共10分)
(1) -----化学.files/image622.gif) (2分)
(2分)
(2) -----化学.files/image624.gif) 、
、-----化学.files/image078.gif) (2分); 不需要(1分)
(2分); 不需要(1分)
(3)22% (2分)
(4) -----化学.files/image627.gif) (1分); 450(2分)
(1分); 450(2分)
23.(15分) w.w.w.k.s.5.u.c.o.m
(1) -----化学.files/image629.gif) (2分)
(2分)
(2)乙(1分) 流程乙中原料-----化学.files/image423.gif) 来源丰富,价格低,工艺流程简单、技术成熟。(2分)
来源丰富,价格低,工艺流程简单、技术成熟。(2分)
(3)①AD(2分)
②经蒸发、浓缩、冷却至
③-----化学.files/image632.gif) (1分) 取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出
(1分) 取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出-----化学.files/image042.gif) ,再往滤液中加
,再往滤液中加-----化学.files/image106.gif) 溶液,如有白色沉淀即可证明含有
溶液,如有白色沉淀即可证明含有-----化学.files/image632.gif) (2分)
(2分)
④解:若该反应完全得到-----化学.files/image426.gif) :
:
-----化学.files/image638.gif) (1分)
(1分)
若蒸发浓缩得到的-----化学.files/image440.gif) 溶液为饱和溶液,其所含的
溶液为饱和溶液,其所含的-----化学.files/image426.gif) :
:
-----化学.files/image641.gif) (1分)
(1分)
-----化学.files/image643.gif) ,则该溶液尚未饱和,
,则该溶液尚未饱和,
-----化学.files/image645.jpg) 24.(11分)
24.(11分)
(1) -----化学.files/image647.gif) (2分)
(2分)
(2)0.75(2分)
(3)①c;(1分)②参看右图(2分)
(4) -----化学.files/image649.gif) (2分)
(2分)
(5)B、D(2分)
五、(本题包括1小题,9分) w.w.w.k.s.5.u.c.o.m
25.(9分)
(1)AD(2分)
(2)Ⅰ.甲酸钠;氧化反应,取代反应。(3分)
Ⅱ.反应②:-----化学.files/image651.jpg) (2分)
(2分)
反应⑥:-----化学.files/image653.jpg) (2分)
(2分)
六、选做题(本题包括2小题,每小题10分。考生只能选做一题。26小题为“有机化学基础”内容的试题,27小题为“物质结构与性质”内容的试题)
26.(10分)答:
(1)①液体分为两层,上层液体无色,下层液体仍是红棕色;②溴水褪色,产生白色浑浊;③活泼。(每空1分,共3分)
(2)Ⅰ.-----化学.files/image655.gif) (1分)
(1分)
Ⅱ.-----化学.files/image657.jpg) (2分)
(2分)
(3) Ⅰ.-----化学.files/image659.jpg) (2分)
(2分)
Ⅱ.先将-----化学.files/image498.gif) 保护起来,防止酚羟基被
保护起来,防止酚羟基被-----化学.files/image662.gif) 氧化,通过反应⑥再重新生成酚羟基。(1分)
氧化,通过反应⑥再重新生成酚羟基。(1分)
Ⅲ.-----化学.files/image664.gif) 过量,使化学平衡向正反应方向移动;或边反应边蒸馏降低
过量,使化学平衡向正反应方向移动;或边反应边蒸馏降低-----化学.files/image666.gif) 的浓度,使化学平衡向正反应方向移动。(1分)
的浓度,使化学平衡向正反应方向移动。(1分)
27.(10分)
(1) -----化学.files/image668.gif) (1分)
(1分)
(2) -----化学.files/image235.gif) 分子结构为
分子结构为-----化学.files/image671.gif) ,键能大,难断裂生成氮的化合物
,键能大,难断裂生成氮的化合物
-----化学.files/image076.gif) 分子结构为
分子结构为-----化学.files/image674.gif) ,键能小,易断裂生成氯的化合物 (2分)
,键能小,易断裂生成氯的化合物 (2分)
(3) -----化学.files/image519.gif) 分子中的
分子中的-----化学.files/image006.gif) 原子采取
原子采取-----化学.files/image678.gif) 杂化,
杂化,-----化学.files/image537.gif) 分子中的
分子中的-----化学.files/image006.gif) 原子采取
原子采取-----化学.files/image681.gif) 杂化(2分),D(1分)
杂化(2分),D(1分)
(4)6(1分);①离子晶体的晶格能愈大,晶体熔点愈高 ②晶体中离子电荷数愈大,晶格能愈大,熔点愈高 ③晶体中离子间距离愈小,晶格能愈大,熔点愈高(2分,答对2条即可)
(5) -----化学.files/image683.gif) (1分)
(1分)
(15分)MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。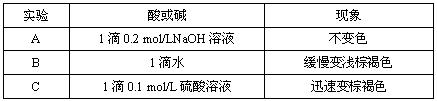
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是 (填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
(15分)
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。
。
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是 (填序号)。




A B C D
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为 。 查看习题详情和答案>>
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质![]()
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 。
A、把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B、把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C、把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D、把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5mL3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2=KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。
。
(5)实验室用二氧化锰和浓盐酸制取氯气,下列仪器可作为该反应的反应容器的是 (填序号)。

![]()
A B C D
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为 。
查看习题详情和答案>>MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
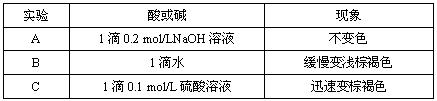
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是 (填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
查看习题详情和答案>>(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。

该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是 (填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
-----化学.files/image577.jpg)