网址:http://m.1010jiajiao.com/timu_id_34062[举报]
 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.已知:过碳酸钠与硫酸溶液反应的化学方程式如下:
Na2CO4+H2SO4→Na2SO4+H2O2+CO2↑ 2H2O2→2H2O+O2↑
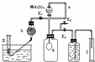
为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为-具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中.
(1)Q内发生反应生成的气体为
(2)为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是
(4)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是
(5)某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积.
为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。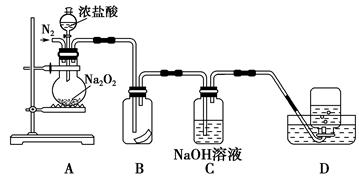
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下:
Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑ 2H2O2 →2H2O+ O2↑
为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
(1)Q内发生反应生成的气体为__________。
在样品中加入少量二氧化锰的目的是________________________________。
导管a作用是_____________________。
(2)为测出反应时生成气体的总体积,滴稀H2SO4前必须
关闭_______(填K1、K2或K3,下同)。打开______。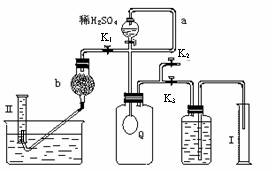
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是___________________,b中装的碱石灰的作用是__________________,为何要缓缓打开K1的理由是_____________________________。
(4)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
(5)某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积
查看习题详情和答案>>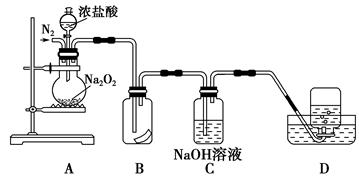
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。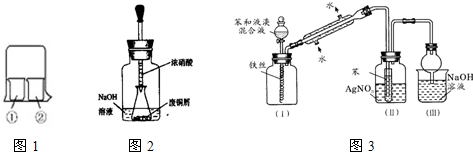
(1)实验室经常用烧杯进行性质实验研究,如用图1所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题.
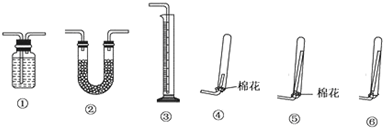
①若要测定生成的NH3的体积,则必须选择的装置是
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1-10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式
(4)图3是苯与溴发生反应并进行产物检验的反应装置实验装置中的冷凝管“左低右高”的放置目的是
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫.
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠.
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠.
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎.
②将研钵中的样品露置在空气中两天.
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡.
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少.
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)
(6)如果要验证③是否成立的实验方法是