摘要:1.B 2.C 3.B 4.B 5.A 6.A 7.BC 8.BC 讲析:2.由于NO2气体中总是存在2NO2(g) N2O4(g),△H<0 这一反应.故通常测得的“NO2的相对分子质量 .往往是NO2与N2O4的平均相对分子质量.故测量值总是偏高.为了尽可能准确地测定NO2的相对分子质量.应使可逆反应尽量向逆反应方向移动.根据化学平衡移动原理.升高温度.减小压强都使平衡向逆反应方向移动.4.增大压强正逆反应速率都增大.则反应物和生成物中一定都有气体.且>.说明正反应是气体体积缩小的反应. 6.运用差量法求解. 7.化学平衡的计算模式: mA2(g)+nB2(g)pC(g) 起始浓度 a a 0 变化浓度 mx nx px 平衡浓度 a-mx a-nx px 据题意:a-mx=0.9 a-nx=0.1 px=0.8 联立解得:n-m=p 对照选项.运用原子守恒.满足关系的是BC.
网址:http://m.1010jiajiao.com/timu_id_3207969[举报]
Ⅰ.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是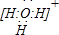
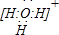 .
.
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为
 ,其中心原子的杂化类型为
,其中心原子的杂化类型为
(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程

(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
(6)请写出Z的原子核外电子排布式
查看习题详情和答案>>
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是
sp3
sp3
,分子空间构型为三角锥
三角锥
,其电子式为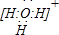
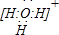
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为


sp3
sp3
,VSEPR模型空间构型为四面体型
四面体型
.(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程


(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
丙烷
丙烷
,A、B、D元素的原子也可以共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式CO2+CO32-+H2O═2HCO3-
CO2+CO32-+H2O═2HCO3-
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
Fe、26
Fe、26
、YCr、24
Cr、24
ZNi、28
Ni、28
.(6)请写出Z的原子核外电子排布式
[Ar]3d84s2
[Ar]3d84s2
,X元素在周期表中的位置第四周期第Ⅷ族
第四周期第Ⅷ族
.A、B、C、D、E、F、G、H、和I,是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A和I相遇产生白烟;
②A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤Mg条能在F中剧烈燃烧,有黑色和白色两种产物;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H 在瓶中混合后于亮处放置几分钟,瓶壁出现油状液滴并产生A.
回答下列问题:
(1)A的化学式是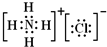
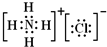 ;
;
(2)④中发生反应的化学方程式是
(3)⑤中发生反应的化学方程式是
(4)C的化学式是
(5)⑦中发生反应的化学方程式是
(6)H的化学式是
查看习题详情和答案>>
①A和I相遇产生白烟;
②A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤Mg条能在F中剧烈燃烧,有黑色和白色两种产物;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H 在瓶中混合后于亮处放置几分钟,瓶壁出现油状液滴并产生A.
回答下列问题:
(1)A的化学式是
HCl
HCl
,②中白烟的电子式是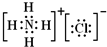
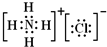
(2)④中发生反应的化学方程式是
Cu+Cl2
CuCl2
| ||
Cu+Cl2
CuCl2
;
| ||
(3)⑤中发生反应的化学方程式是
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
;
| ||
(4)C的化学式是
NO
NO
,D的化学式是O2
O2
;(5)⑦中发生反应的化学方程式是
2H2S+3O2
2SO2+2H2O
| ||
2H2S+3O2
2SO2+2H2O
;
| ||
(6)H的化学式是
CH4
CH4
.A、B、C、D、E、F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)写出A与E形成的化合物的电子式
 .
.
(2)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
(3)F的盐酸盐水溶液呈酸性,原因是
(4)化合物M是一种元素C的+6含氧酸钾盐,常用作净水剂与消毒剂.由元素C稳定的氢氧化物与次氯酸钾、氢氧化钾溶液反应制取化合物M,则制备M的离子反应方程式是
查看习题详情和答案>>
| 元素 | 原子结构或性质 | ||
| A | 原子最外层电子数是内层电子总数的
| ||
| B | 形成化合物种类最多的元素,其单质为固体 | ||
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 | ||
| D | 地壳中含量最多的元素 | ||
| E | 与D同主族 | ||
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)写出A与E形成的化合物的电子式


(2)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是
C+H2O
CO+H2
| ||
C+H2O
CO+H2
| ||
(3)F的盐酸盐水溶液呈酸性,原因是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
| ||
(4)化合物M是一种元素C的+6含氧酸钾盐,常用作净水剂与消毒剂.由元素C稳定的氢氧化物与次氯酸钾、氢氧化钾溶液反应制取化合物M,则制备M的离子反应方程式是
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
.A、B、C、D、E、F、G是中学化学中常见的气体,它们具有如下性质:①A、B、E、F能使湿润的蓝色石蕊试纸变红,G能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色;②A和G相遇产生白烟;③B和E都能使品红溶液褪色;④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;⑥G与C在一定条件下反应生产D,C、D相遇生成红棕色气体;⑦E是酸雨的主要成分.回答下列问题:
(1)A的分子式
(2)②中生成白烟的化学方程式
(3)④中发生反应的化学方程式
(4)⑤中发生反应的化学方程式
(5)用电离方程式表示G使湿润的红色石蕊试纸变蓝的原因:
(6)E与B的水溶液反应的方程式
查看习题详情和答案>>
(1)A的分子式
HCl
HCl
,C的分子式O2
O2
;(2)②中生成白烟的化学方程式
NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;(3)④中发生反应的化学方程式
Cu+Cl2
CuCl2
| ||
Cu+Cl2
CuCl2
;
| ||
(4)⑤中发生反应的化学方程式
CO2+2Mg
2MgO+C
| ||
CO2+2Mg
2MgO+C
;
| ||
(5)用电离方程式表示G使湿润的红色石蕊试纸变蓝的原因:
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
(6)E与B的水溶液反应的方程式
Cl2+SO2+2H2O=H2SO4+2HCl
Cl2+SO2+2H2O=H2SO4+2HCl
.