摘要:12.Na2O2与CO2/H2O反应 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O+4NaOH+O2
网址:http://m.1010jiajiao.com/timu_id_3207392[举报]
在高一化学教材中,介绍了过氧化钠与二氧化碳及水的反应:
2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过 (从以下选项中选择最佳方案)可以使NO2得以净化.
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
步骤二:操作(如图,b、c为弹簧夹)
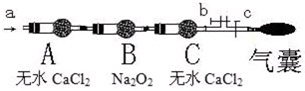
①先打开b关闭c,通入 (从所给选项选出)5分钟;目的是
A.空气 B.O2C.CO2 D.N2
②然后 ,再分别从a处通入NO或NO22分钟.
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:
请写出NO2与 Na2O2反应的化学方程式: .
查看习题详情和答案>>
2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
步骤二:操作(如图,b、c为弹簧夹)

①先打开b关闭c,通入
A.空气 B.O2C.CO2 D.N2
②然后
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:
请写出NO2与 Na2O2反应的化学方程式:
在高一化学教材中,介绍了过氧化钠与二氧化碳及水的反应:
2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:________
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过________(从以下选项中选择最佳方案)可以使NO2得以净化.
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
步骤二:操作(如图,b、c为弹簧夹)
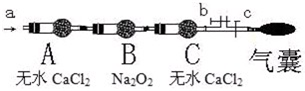
①先打开b关闭c,通入________(从所给选项选出)5分钟;目的是________
A.空气 B.O2C.CO2 D.N2
②然后________,再分别从a处通入NO或NO22分钟.
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:________
请写出NO2与 Na2O2反应的化学方程式:________.
查看习题详情和答案>>
已知Na2O2与CO2 、H2O反应的方程式是:
①2Na2O2+2CO2=2Na2CO3+O2 ;②2Na2O2+2H2O =4NaOH+O2↑
现将8.4 g CO2和H2O的混合气体,通入足量的Na2O2中,可得O2(标准状况)2.8 L,求原混合气体中CO2与H2O的物质的量各是多少?
查看习题详情和答案>>
已知Na2O2与CO2 、H2O反应的方程式是:①2Na2O2+2CO2=2Na2CO3+O2 ;
②2Na2O2+2H2O =4NaOH+O2↑ 将8.4 g 的CO2和H2O混合气体,通入足量的Na2O2中,可得O2(标准状况)2.8 L,求原混合气体中CO2的物质的量和H2O的质量?
查看习题详情和答案>> 某同学在实验室进行如图所示的过氧化钠性质实验.请回答下列问题.
某同学在实验室进行如图所示的过氧化钠性质实验.请回答下列问题.(1)过氧化钠与水反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.过氧化钠中氧元素的化合价为-1
-1
.(2)如图所示实验,滴入几滴水,现象是
固体溶解,得到无色溶液,冒气泡
固体溶解,得到无色溶液,冒气泡
,实验结束后,向试管所得溶液中滴加酚酞溶液,现象是溶液显示红色
溶液显示红色
.(3)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧.原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为
2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2CO2=2Na2CO3+O2↑
.