题目内容
已知Na2O2与CO2 、H2O反应的方程式是:①2Na2O2+2CO2=2Na2CO3+O2 ;
②2Na2O2+2H2O =4NaOH+O2↑ 将8.4 g 的CO2和H2O混合气体,通入足量的Na2O2中,可得O2(标准状况)2.8 L,求原混合气体中CO2的物质的量和H2O的质量?
解:设原混合气体中CO2和H2O的物质的量分别为x、y,
2Na2O2 + 2CO2 = 2Na2CO3 + O2
x x/2 (1分)
2Na2O2 + 2H2O = 4NaOH + O2↑
y y /2 (1分)
x×44 g · mol-1+y×18 g · mol-1=8.4 g……① (1分)
x/2 + y/2 =2.8 L /22.4L·mol-1=0.125 mol……② (1分)
解①和②所组成的方程组,得x=0.15 mol (1分) y=0.1 mol (1分)
m(H2O)=0.1mol ×18g/mol = 1.8g(1分) 答: (1分)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
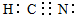
 CH3COOH+OH-
CH3COOH+OH-

 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
 CO2↑+CO↑+H2O若CO能够与Na2O2发生反应,则预测反应产物为______;验证该产物可选择的试剂是______.上述实验中选择的最简单的装置接口连接顺序为______.
CO2↑+CO↑+H2O若CO能够与Na2O2发生反应,则预测反应产物为______;验证该产物可选择的试剂是______.上述实验中选择的最简单的装置接口连接顺序为______.


 CO2↑+CO↑+H2O若CO能够与Na2O2发生反应,则预测反应产物为______;验证该产物可选择的试剂是______.上述实验中选择的最简单的装置接口连接顺序为______.
CO2↑+CO↑+H2O若CO能够与Na2O2发生反应,则预测反应产物为______;验证该产物可选择的试剂是______.上述实验中选择的最简单的装置接口连接顺序为______.
