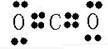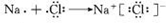摘要:有A.B.C.D.E五种短周期元素.它们的原子序数依次增大.其中B是地壳中含量最多的元素.已知A.C及B.D分别是同主族元素.且B.D两元素原子核内质子数之和是A.C两元素原子核内质子数之和的2倍,在处于同周期的C.D.E三元素中.E的原子半径最小,通常条件下.五种元素的单质中有三种气体.两种固体.(1)B.C两元素按原子个数1:1组成的化合物F中的阴阳离子比为 .F中既存在离子键又存在 共价键(填“极性 或“非极性 .)(2)试比较D.E两元素的最高价氧化物对应水化物的酸性强弱: > (3)将E单质通入A.B.C三种元素组成的化合物的水溶液中.写出反应的离子方程式: .(4)写出两种均含A.B.C.D四种元素的化合物在溶液中相互反应.且生成气体的化学方程式: .
网址:http://m.1010jiajiao.com/timu_id_307502[举报]
 有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.
有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.试根据以上叙述回答:
(1)写出元素名称:A
碳
碳
E硫
硫
,写出D的原子符号2412Mg
2412Mg
(标出质子数和质量数)(2)画出C的原子结构示意图


(3)写出AB2与C2B2反应的化学方程式
2CO2+2Na2O2=2Na2CO3+O2
2CO2+2Na2O2=2Na2CO3+O2
.(4)比较B和E的气态氢化物的稳定性(用化学式回答):
H2O>H2S
H2O>H2S
.(5)判断C元素和D元素的金属性强弱,简要地说明你的一个判断依据:
金属性 Na>Mg,钠跟冷水能反应,镁和冷水不反应 或其他合理答案
金属性 Na>Mg,钠跟冷水能反应,镁和冷水不反应 或其他合理答案
.有A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D 都能分别与B按原子个数比为1:1 或2:1形成化合物;AC可与EB2反应生成A2B与气态物质EC4;E的M层电子数是K层电子数的2倍.
(1)画出E的原子结构示意图
 ;写出电子式D2B2
;写出电子式D2B2
 ;写出化学式EC4
;写出化学式EC4
(2)比较EB2与EC4的沸点高低(填化学式)
(3)用电子式表示化合物DC的形成过程
 .
.
查看习题详情和答案>>
(1)画出E的原子结构示意图




SiF4
SiF4
.(2)比较EB2与EC4的沸点高低(填化学式)
SiO2
SiO2
>SiF4
SiF4
.(3)用电子式表示化合物DC的形成过程


 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
(1)写出相应元素符合,A
H
H
BN
N
CO
O
ES
S
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:
c(Na+)>c(HSO3-)>c(H+ )>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+ )>c(SO32-)>c(OH-)
.(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
2Al-6e-+8OH-=2AlO2-+4H2O
2Al-6e-+8OH-=2AlO2-+4H2O
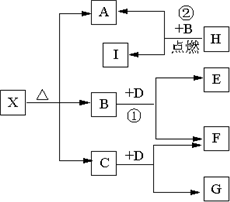
.Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:
NaOH
NaOH
.(2)写出下列反应的化学方程式
①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
②2Mg+CO2  2MgO+C
2MgO+C
 2MgO+C
2MgO+C2Mg+CO2  2MgO+C
2MgO+C
. 2MgO+C
2MgO+C(1)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小.请回答:
①A2B和A2D的沸点较高者是 (填化学式),其原因是 ;
②C在元素周期表的位置是 ,C的第一电离能比D的 (填“大”或“小”);
③E的基态原子核外电子排布式为: ,E的电负性比D的 (填“大”或“小”);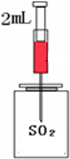
(2)某研究性学习小组在探究SO2的性质时设计了如图装置进行实验.
①将注射器中2mL品红溶液注入集满SO2气体的瓶中,进入瓶中的品红溶液褪为无色,则证明SO2具有 性;
②将注射器中2mL (填名称)溶液注入集满SO2的玻璃瓶中,看到 现象,可证明SO2是酸性氧化物;
③将注射器中2mL橙红色溴水注入集满SO2的玻璃中,溴水褪色,可证明SO2具有还原性.此反应的化学方程式为 .
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.N2H4在氧气中完全燃烧生成氮气.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是: ;又知1克液态N2H4和足量液态H2O2反应生成氮气和水蒸气时放出20.05kJ的热量,请写出此反应的热化学方程式 .
查看习题详情和答案>>
①A2B和A2D的沸点较高者是
②C在元素周期表的位置是
③E的基态原子核外电子排布式为:

(2)某研究性学习小组在探究SO2的性质时设计了如图装置进行实验.
①将注射器中2mL品红溶液注入集满SO2气体的瓶中,进入瓶中的品红溶液褪为无色,则证明SO2具有
②将注射器中2mL
③将注射器中2mL橙红色溴水注入集满SO2的玻璃中,溴水褪色,可证明SO2具有还原性.此反应的化学方程式为
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.N2H4在氧气中完全燃烧生成氮气.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是: