摘要:过滤, (3)电解
网址:http://m.1010jiajiao.com/timu_id_302102[举报]
(2013?江西二模)以食盐为原料进行生产并综合利用的某些过程如图所示.
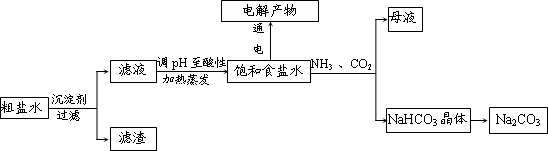
(1)除去粗盐中的Ca2+、Mg2+和SO4-2离子,加入下列沉淀剂的顺序是(填序号)
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).
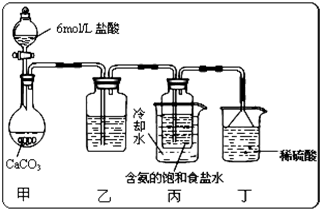
试回答下列有关问题:
①乙装置中的试剂是
②丁装置中稀硫酸的作用是
③实验结束后,分离出NaHCO3 晶体的操作是
(6)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
查看习题详情和答案>>

(1)除去粗盐中的Ca2+、Mg2+和SO4-2离子,加入下列沉淀剂的顺序是(填序号)
cab或cba或bca
cab或cba或bca
.a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
CO32-和OH-
CO32-和OH-
.(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
NH3
NH3
.(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
①乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
;②丁装置中稀硫酸的作用是
吸收未反应的氨气
吸收未反应的氨气
;③实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称).(6)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解而被除去
碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解而被除去
.②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
.(已知碳酸的酸性强于次氯酸).(2010?西城区一模)工业上以锂辉石(Li2O?Al2O3?4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:
已知:①Li2O?Al2O3?4SiO2+H2SO4(浓)
Li2SO4+Al2O3?4SiO2?H2O↓
②某些物质的溶解度(S)如下表所示.
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是
②b中,生成Li2CO3反应的化学方程式是
查看习题详情和答案>>

已知:①Li2O?Al2O3?4SiO2+H2SO4(浓)
| ||
②某些物质的溶解度(S)如下表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)
增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出
增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出
.(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
.(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是
2C1--2e-=Cl2↑
2C1--2e-=Cl2↑
.②b中,生成Li2CO3反应的化学方程式是
2Li2OH+NH4HCO3=Li2CO3+NH3+2H2O
2Li2OH+NH4HCO3=Li2CO3+NH3+2H2O
.(2011?武胜县一模)现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
(2)将F从混合物中分离出来的实验操作步骤为
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
查看习题详情和答案>>

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
. 生成的氧化产物与还原产物的物质的量之比为5:1
5:1
;(2)将F从混合物中分离出来的实验操作步骤为
溶解
溶解
、过滤
过滤
、蒸发
蒸发
.由A制得2mol D时,转移电子数为4
4
mol(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
,若将浓度为 c mol?L-1 的M溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为
| ||
c(K+)=c(A-)>c(OH-)=c(H+)
c(K+)=c(A-)>c(OH-)=c(H+)
(浓度用C表示).(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
;将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
2
2
Fe(OH)3+4
4
NaOH+3
3
NaClO=2
2
Na2FeO4+3
3
NaCl+5
5
H2O.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下所示:
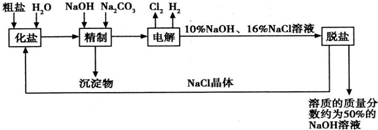
请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为
(2)粗盐中含Ca2+、Mg2+等杂质.精制过程中发生反应的离子方程式为
(3)为有效除去Ca2+、Mg2+和S
,加入试剂的合理顺序是
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3,
C.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(5)采用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学反应方程式为
查看习题详情和答案>>

请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,与电源负极相连的电极附近,溶液的pH升高
升高
(填“不变”、“升高”或“降低”).(2)粗盐中含Ca2+、Mg2+等杂质.精制过程中发生反应的离子方程式为
Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓
Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓
.(3)为有效除去Ca2+、Mg2+和S
| O | 2- 4 |
bc
bc
(填序号).a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3,
C.先加钡试剂,后加NaOH,再加Na2CO3
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
蒸发
蒸发
、冷却、过滤
过滤
(填操作名称)除去NaCl.(5)采用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学反应方程式为
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如图所示.
根据上图所示步骤并参考表格数据,回答下列问题.
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式: .
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是 .

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 .
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 .
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为 .
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为 .
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 .
查看习题详情和答案>>

根据上图所示步骤并参考表格数据,回答下列问题.
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60min,其可能原因是

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为
(6)工业上利用KOH和MnO2为原料制取KMnO4.主要生产过程分两步进行:
第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4.
①第一步反应的化学方程式为
②电解K2MnO4的浓溶液时,电解池中阴极的实验现象为