摘要:过氧化氢溶液中溶质的质量分数为: 答:该溶液中溶质的质量分数为2%. 考点二 金属与酸反应图像题 例2 用质量相等的锌粉和铁粉,分别与溶质质量分数相同,等质量的稀盐酸充分发挥反应,产生氢气与时间关系如图所示.则下列说法不可能的是
网址:http://m.1010jiajiao.com/timu_id_301694[举报]
1、B 2、C 3、B 4、C 5、Y>X>Z;Z>Y>X 6、34g
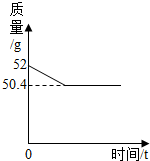 为了测定一瓶过氧化氢溶液中溶质的质量分数,某同学取该溶液50g倒入烧杯中,然后向其中加入2g二氧化锰,烧杯内混合物的质量与反应时间的变化关系如图所示.
为了测定一瓶过氧化氢溶液中溶质的质量分数,某同学取该溶液50g倒入烧杯中,然后向其中加入2g二氧化锰,烧杯内混合物的质量与反应时间的变化关系如图所示.(1)反应完全后产生氧气的质量为
1.6g
1.6g
.(2)欲从反应后的混合物中回收二氧化锰,应进行的操作是
过滤
过滤
、干燥.(3)计算该过氧化氢溶液中溶质的质量分数(结果保留至0.1%).
实验室制取氧气的实践与研究.

(1)过氧化氢是一种无色透明的无毒液体,过氧化氢溶液俗称“双氧水”,具有强氧化性.贮运过氧化氢的试剂箱上最适合粘贴的一张标识是 (从上图中选填字母序号).
(2)过氧化氢溶液常用于实验室制取氧气.可供选择的仪器或装置如下图所示.
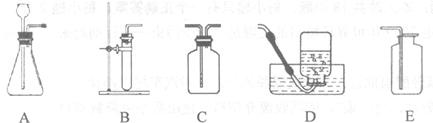
①要收集干燥的氧气,整套装置的连接顺序为(由气体发生装置开始) (选填字母A~E);
②加入药品通常采用“把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中”,优点是 ;
③MnO2可以连续反应使用,理由是 ;
④根据化学方程式计算获得的氧气理论值总是比实际实验操作收集到气体的数值大(若装置不漏气且实验操作正确),原因是 .
(3)生产火箭燃料的工业废水中含有少量偏二甲肼X,可用双氧水处理排污,反应的化学方程式为X+8H2O2=2CO2↑+N2↑+12H2O,则X的化学式为 .
(4)85g过氧化氢溶液加入wg二氧化锰反应完全后,留下混合物质量仍为85g,则过氧化氢溶液中溶质的质量分数为 .
查看习题详情和答案>>

(1)过氧化氢是一种无色透明的无毒液体,过氧化氢溶液俗称“双氧水”,具有强氧化性.贮运过氧化氢的试剂箱上最适合粘贴的一张标识是
(2)过氧化氢溶液常用于实验室制取氧气.可供选择的仪器或装置如下图所示.

①要收集干燥的氧气,整套装置的连接顺序为(由气体发生装置开始)
②加入药品通常采用“把过氧化氢溶液缓缓加入盛有少量MnO2的反应容器中”,优点是
③MnO2可以连续反应使用,理由是
④根据化学方程式计算获得的氧气理论值总是比实际实验操作收集到气体的数值大(若装置不漏气且实验操作正确),原因是
(3)生产火箭燃料的工业废水中含有少量偏二甲肼X,可用双氧水处理排污,反应的化学方程式为X+8H2O2=2CO2↑+N2↑+12H2O,则X的化学式为
(4)85g过氧化氢溶液加入wg二氧化锰反应完全后,留下混合物质量仍为85g,则过氧化氢溶液中溶质的质量分数为
(2005?西城区二模)如图,实验室常用一定质量分数的过氧化氢无色溶液(溶质为H2O2),在二氧化锰作催化剂的条件下反应来制取氧气
(2H2O2
2H2O+O2↑).某同学实验前测得过氧化氢溶液42.5g,加入1g MnO2,完全反应后测得反应容器中剩余物质量为41.9g.
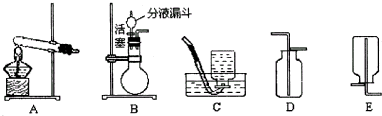
请回答:
(1)实验室用分解双氧水的方法制取氧气时,选择的发生装置应为
(2)收集装置应选择
(3)反应后放出氧气的质量是
查看习题详情和答案>>
(2H2O2
| ||

请回答:
(1)实验室用分解双氧水的方法制取氧气时,选择的发生装置应为
B
B
.(2)收集装置应选择
C或D
C或D
,原因是氧气不易溶于水且比空气的密度大
氧气不易溶于水且比空气的密度大
.(3)反应后放出氧气的质量是
1.6g
1.6g
,所用过氧化氢溶液中溶质的质量分数为8%
8%
.(2013?东台市模拟)化学是一门实验课,同学们应该掌握一些规范的实验操作技能.结合下图实验装置,回答问题.
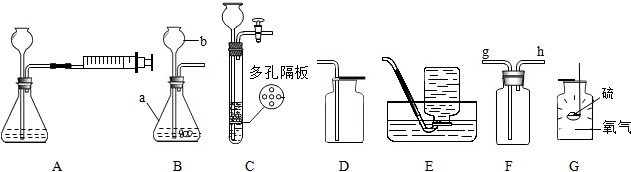
①图中a、b仪器的名称:a
图A表示加入药品前的一个操作,其目的是
②小毛想收集干燥的氧气,整套装置的连接顺序为(由气体发生装置开始)
③小凯选用装置G做硫在氧气中燃烧的实验,他的实验易造成后果是:
④装置C具有随时使反应发生或停止的特点,用该发生装置制取气体需满足的一般条件是
⑤85g过氧化氢溶液加入a g二氧化锰反应完全后,留下混合物质量仍为85g,则过氧化氢溶液中溶质的质量分数为
查看习题详情和答案>>

①图中a、b仪器的名称:a
锥形瓶
锥形瓶
,b长颈漏斗
长颈漏斗
.图A表示加入药品前的一个操作,其目的是
检查装置的气密性
检查装置的气密性
.②小毛想收集干燥的氧气,整套装置的连接顺序为(由气体发生装置开始)
BFD
BFD
(选填字母A~G);该反应的化学方程式是2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
③小凯选用装置G做硫在氧气中燃烧的实验,他的实验易造成后果是:
污染空气
污染空气
;学习了酸碱盐知识后,为了防止上述后果,你的改进方法是在集气瓶中预先放入氢氧化钠溶液
在集气瓶中预先放入氢氧化钠溶液
.④装置C具有随时使反应发生或停止的特点,用该发生装置制取气体需满足的一般条件是
固体与液体常温下进行反应
固体与液体常温下进行反应
.⑤85g过氧化氢溶液加入a g二氧化锰反应完全后,留下混合物质量仍为85g,则过氧化氢溶液中溶质的质量分数为
2.5a%
2.5a%
. (2011?静安区二模)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O逸出):
(2011?静安区二模)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O逸出):| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 装置+过氧化氢溶液 +二氧化锰/g |
335.70 | 333.78 | 332.64 | 332.58 | 332.50 | 332.50 | 332.50 |
①发生反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
②生成氧气的物质的量为
0.1
0.1
mol;③根据上述氧气的量计算分解过氧化氢的物质的量(根据化学方程式列式计算)
0.2mol
0.2mol
;④瓶内过氧化氢溶液中溶质的质量分数为
20%
20%
.