题目内容
 (2011?静安区二模)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O逸出):
(2011?静安区二模)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰.不同时间电子天平的读数如下表所示(不考虑H2O逸出):| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 装置+过氧化氢溶液 +二氧化锰/g |
335.70 | 333.78 | 332.64 | 332.58 | 332.50 | 332.50 | 332.50 |
①发生反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
②生成氧气的物质的量为
0.1
0.1
mol;③根据上述氧气的量计算分解过氧化氢的物质的量(根据化学方程式列式计算)
0.2mol
0.2mol
;④瓶内过氧化氢溶液中溶质的质量分数为
20%
20%
.分析:①本题中所发生的反应为过氧化氢的分解反应;
②根据质量守恒定律,反应前即时间为0时烧瓶及所盛物质总质量与完全反应后即不再产生气体时间为5min时烧瓶及所盛物质总质量的差,即为反应放出气体氧气的质量;
③根据过氧化氢在二氧化锰催化下分解生成水和氧气的化学方程式,由生成氧气的物质的量计算出反应消耗过氧化氢物质的量;
④利用所计算溶质过氧化氢的质量运用溶质质量分数计算公式 进行计算即可,计算出所用溶液中溶质的质量分数.
②根据质量守恒定律,反应前即时间为0时烧瓶及所盛物质总质量与完全反应后即不再产生气体时间为5min时烧瓶及所盛物质总质量的差,即为反应放出气体氧气的质量;
③根据过氧化氢在二氧化锰催化下分解生成水和氧气的化学方程式,由生成氧气的物质的量计算出反应消耗过氧化氢物质的量;
④利用所计算溶质过氧化氢的质量运用溶质质量分数计算公式 进行计算即可,计算出所用溶液中溶质的质量分数.
解答:解:①过氧化氢在二氧化锰的催化作用之下分解产生了氧气和水;其化学方程式为:2H2O2
2H2O+O2↑;
②根据质量守恒定律可以知道:烧瓶及所剩余物质的总质量为332.50g,反应前后的质量差即为放出氧气的质量,反应生成氧气质量=335.70g-332.50g=3.2g,即生成氧气的质量为3.2g,其物质的量为:3.2g÷32g/mol=0.1mol;
③设过氧化氢的物质的量为x
2H2O2
2H2O+O2↑
2 1
x 0.1mol
=
解得:x=0.2mol
答:过氧化氢的质量为6.8g;
③过氧化氢溶液的质量分数=
×100%=20%
答:③根据上述氧气的量计算分解过氧化氢的物质的量为0.2mol;④瓶内过氧化氢溶液中溶质的质量分数为20%.
故答案为:
①2H2O2
2H2O+O2↑;
②0.1mol;
③0.2mol;
④20%.
| ||
②根据质量守恒定律可以知道:烧瓶及所剩余物质的总质量为332.50g,反应前后的质量差即为放出氧气的质量,反应生成氧气质量=335.70g-332.50g=3.2g,即生成氧气的质量为3.2g,其物质的量为:3.2g÷32g/mol=0.1mol;
③设过氧化氢的物质的量为x
2H2O2
| ||
2 1
x 0.1mol
| 2 |
| x |
| 1 |
| 0.1mol |
解得:x=0.2mol
答:过氧化氢的质量为6.8g;
③过氧化氢溶液的质量分数=
| 0.2mol×34g/mol |
| 34g |
答:③根据上述氧气的量计算分解过氧化氢的物质的量为0.2mol;④瓶内过氧化氢溶液中溶质的质量分数为20%.
故答案为:
①2H2O2
| ||
②0.1mol;
③0.2mol;
④20%.
点评:根据质量守恒定律可以知道,天平的读数随反应时间的增加越来越小是由于反应不断放出气体氧气所致,待读数不变时,说明已完全反应,不再产生气体.

练习册系列答案
相关题目
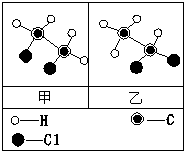 (2011?静安区二模)甲(化学式为C2H4Cl2)和乙的分子结构示意图如图所示.资料表明:甲、乙的结构不同,性质也有一定差异.小明根据甲和乙的分子结构和性质得出如下结论,其中错误的是
(2011?静安区二模)甲(化学式为C2H4Cl2)和乙的分子结构示意图如图所示.资料表明:甲、乙的结构不同,性质也有一定差异.小明根据甲和乙的分子结构和性质得出如下结论,其中错误的是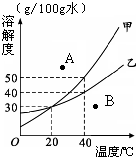 (2011?静安区二模)如图是某实验小组绘制的甲乙两种固体物质的溶解度曲线图.请你根据图示回答问题:
(2011?静安区二模)如图是某实验小组绘制的甲乙两种固体物质的溶解度曲线图.请你根据图示回答问题: