摘要:D.
网址:http://m.1010jiajiao.com/timu_id_287651[举报]
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
(3)D和Y形成的化合物,其分子的空间构型为
(4)D和X形成的化合物,其化学键类型属
(5)金属镁和E的单质在高温下反应得到的产物是
查看习题详情和答案>>
(1)Y的最高价氧化物的化学式为
SO3
SO3
.(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
Cl
Cl
,写出该元素的最高价含氧酸的化学式:HClO4
HClO4
.(3)D和Y形成的化合物,其分子的空间构型为
直线型
直线型
.(4)D和X形成的化合物,其化学键类型属
极性共价键
极性共价键
,其晶体类型属原子晶体
原子晶体
.(5)金属镁和E的单质在高温下反应得到的产物是
Mg3N2
Mg3N2
,此产物与水反应生成两种碱,该反应的化学方程式是Mg3N2+8H2O=3Mg(OH)2+2NH3.H2O
Mg3N2+8H2O=3Mg(OH)2+2NH3.H2O
. Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.(1)N2H4、N2O、NO、HNO2、N2O4、HNO3(
氮元素的化合价依次升高
氮元素的化合价依次升高
)(2)CH4、C2H6、C3H8、C4H10、C5H12 (
分子组成依次增加1个“CH2”原子团
分子组成依次增加1个“CH2”原子团
)(3)Ca、Mg、Fe、Cu、Pt (
金属活动性依次升高
金属活动性依次升高
)Ⅱ. A、B、C、D、E为常见物质,已知A溶液为蓝色,B是一种碱,C是碱性氧化物,D和E为金属单质,回答:
(1)写出A、B、C的化学式:A
CuSO4
CuSO4
;BCu(OH)2
Cu(OH)2
;CCuO
CuO
;DCu
Cu
;EFe
Fe
(2)写出下列各步的化学反应方程式:
A→B:
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
;A→D:
CuSO4+Fe=FeSO4+Cu
CuSO4+Fe=FeSO4+Cu
.Ⅲ.有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
FeSO4
FeS+2O2↑
| ||
FeSO4
FeS+2O2↑
;
| ||
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
FeSO4
FeO+SO3
| ||
FeSO4
FeO+SO3
.
| ||
Ⅰ.如图所示A~H为实验室常见的仪器、装置(部分固定夹持装置略去),请根据要求回答下列问题:
(1)A仪器的名称是
(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接
Ⅱ.为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸).
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是
(4)实验过程中,装置Ⅳ中的实验现象为
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象.为了达到这一实验目的,你认为应在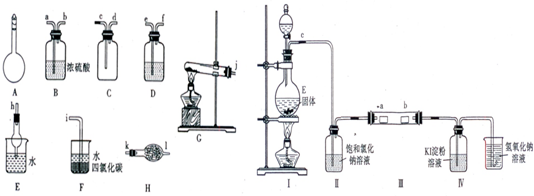
查看习题详情和答案>>
(1)A仪器的名称是
容量瓶
容量瓶
,常用于配制一定物质的量浓度的溶液
配制一定物质的量浓度的溶液
.(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接
接k、l接d、c接h或I
接k、l接d、c接h或I
.Ⅱ.为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸).
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是
用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,有液体液面高于烧瓶液面,但不流下,则气密性好
用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,有液体液面高于烧瓶液面,但不流下,则气密性好
.(4)实验过程中,装置Ⅳ中的实验现象为
无色液体变蓝色
无色液体变蓝色
.(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象.为了达到这一实验目的,你认为应在
Ⅱ、Ⅲ
Ⅱ、Ⅲ
之间(选填装置序号)还需添加一个洗气瓶,该装置的作用是干燥氯气
干燥氯气
.
Ⅰ.现有标准状况下的以下物质:
A.11.2LO2 B.6.8gNH3 C.1.204×1024CH4 D.0.5molCO2;
其中质量由大到小的顺序为
Ⅱ.相同质量的CO和CO2,其物质的量之比为
查看习题详情和答案>>
A.11.2LO2 B.6.8gNH3 C.1.204×1024CH4 D.0.5molCO2;
其中质量由大到小的顺序为
C>D>A>B
C>D>A>B
,各物质所含原子数由大到小的顺序是C>B>D>A
C>B>D>A
,其体积由大到小的顺序是C>A=D>B
C>A=D>B
,气体的密度由大到小的顺序是D>A>B>C
D>A>B>C
.(填序号)Ⅱ.相同质量的CO和CO2,其物质的量之比为
11:7
11:7
,所含的氧原子个数比为11:14
11:14
,所含碳元素的质量比为11:7
11:7
,相同条件下的体积比为11:7
11:7
.Ⅰ.同学甲选用下图所示仪器制备少量无水FeCl3,仪器连接顺序正确的是:
a→e→d→

Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.提出一个相似的观点:氯气与铁粉反应,当C12足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3;B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验.请填写下表中的相应空格.
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:
(4)实际应用:FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜.该方案涉及的四种阳离子的氧化性由强到弱的顺序为:
查看习题详情和答案>>
a→e→d→
c
c
→b
b
→h
h
→j
j
→g
g
.
Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.提出一个相似的观点:氯气与铁粉反应,当C12足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3;B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验.请填写下表中的相应空格.
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中含有FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
;
| ||
(4)实际应用:FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜.该方案涉及的四种阳离子的氧化性由强到弱的顺序为:
Fe3+>Cu2+>H+>Fe2+
Fe3+>Cu2+>H+>Fe2+
;请写出该方案涉及的反应的离子方程式:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2Fe3++Cu=2Fe2++Cu2+、Fe+2H+=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2Fe3++Cu=2Fe2++Cu2+、Fe+2H+=Fe2++H2↑
.