题目内容
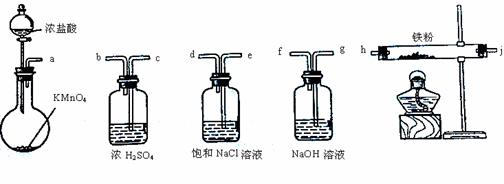
a→e→d→

Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.提出一个相似的观点:氯气与铁粉反应,当C12足量时生成FeCl3,当铁粉过量时产物是FeCl2.为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分.探究过程如下:
(1)提出假设:A是FeCl3;B是FeCl2.
(2)设计实验方案:分别取A、B的溶液均进行以下实验.请填写下表中的相应空格.
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中含有FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
(4)实际应用:FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤.在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜.该方案涉及的四种阳离子的氧化性由强到弱的顺序为:
II.(2)铁离子和硫氰根离子反应生成血红色硫氰化铁,亚铁离子具有还原性能被酸性高锰酸钾氧化;
(3)在点燃条件下,氯气和铁反应生成氯化铁;
(4)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
Ⅱ.(2)铁离子和硫氰根离子反应生成血红色硫氰化铁,分别向A、B溶液中加KSCN溶液,溶液中含有氯化铁,铁离子和硫氰化钾反应反应而使溶液呈血红色,亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,如果向分别向KMnO4溶液中加入适量A、B溶液,KMnO4溶液颜色无明显变化,说明不含氯化亚铁,
故答案为:溶液变红色;FeCl2;
(3)在点燃条件下,铁在氯气中燃烧生成氯化铁,反应方程式为:2Fe+3Cl2
| ||
故答案为:2Fe+3Cl2
| ||
(4)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,
铁和铁离子反应生成亚铁离子,反应方程式为:2Fe3++Fe=3Fe2+,铜离子和铁反应方程式为:Cu2++Fe=Fe2++Cu,铁离子和铜的反应方程式为:2Fe3++Cu=2Fe2++Cu2+,铁和氢离子反应方程式为:Fe+2H+=Fe2++H2↑,所以四种阳离子的氧化性由强到弱的顺序为:Fe3+>Cu2+>H+>Fe2+,
故答案为:Fe3+>Cu2+>H+>Fe2+;2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2Fe3++Cu=2Fe2++Cu2+、Fe+2H+=Fe2++H2↑.

Ⅰ.同学甲选用下图所示仪器制备少量无水FeCl3,仪器连接顺序正确的是a→e→d→ → → → → 。
Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。提出一个相似的观点:氯气与铁粉反应,当C12足量时生成FeC13,当铁粉过量时产物是FeCl2。为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的C12中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3;B是FeCl2。
(2)设计实验方案:分别取A、B的溶液均进行以下实验。请填写下表中的相应空格。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 |
| 固体物质中含有FeC13 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
(3)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________;
(4)实际应用:FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeC13、FeCl2、CuCl2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。该方案涉及的四种阳离子的氧化性由强到弱的顺序为:______________________________;请写出该方案涉及的反应的离子方程式:
______________________________________。