摘要:1.用实物投影仪展示学生们的设计方案.
网址:http://m.1010jiajiao.com/timu_id_287607[举报]
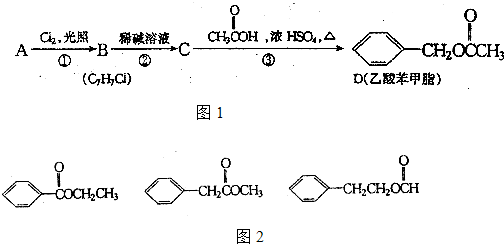
H是一种香料,可用如图的设计方案合成.
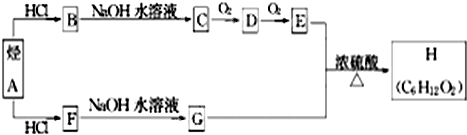
已知:①在一定条件下,有机物有下列转化关系:
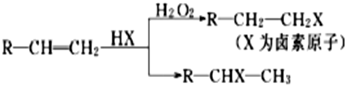
②烃A和等物质的量的HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F.
(1)D的结构简式为
(2)烃A→B的化学反应方程式是
(3)F→G的化学反应类型为
(4)E+G→H的化学反应方程式
(5)H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是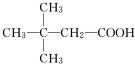
 .(用结构简式表示)
.(用结构简式表示)
查看习题详情和答案>>

已知:①在一定条件下,有机物有下列转化关系:

②烃A和等物质的量的HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F.
(1)D的结构简式为
CH3CH2CHO
CH3CH2CHO
,其核磁共振氢谱有3
3
组峰.(2)烃A→B的化学反应方程式是
CH3CH=CH2+HCl→CH3CH2CH2Cl
CH3CH=CH2+HCl→CH3CH2CH2Cl
.(3)F→G的化学反应类型为
取代反应
取代反应
.(4)E+G→H的化学反应方程式
CH3CH2COOH+CH3CH(OH)CH3
CH3CH2COOCH(CH3)2+H2O
| 浓硫酸 |
| △ |
CH3CH2COOH+CH3CH(OH)CH3
CH3CH2COOCH(CH3)2+H2O
.| 浓硫酸 |
| △ |
(5)H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是


 (2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
(2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度.
(1)甲同学的方案是否可行,说出理由:
不可行,Fe也会和盐酸反应
不可行,Fe也会和盐酸反应
.乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:

(2)配制5%的盐酸1L (ρ=1.025g/cm3 ),需取用36.5% (ρ=1.181g/cm3 )的盐酸
118.9
118.9
mL(保留一位小数).(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为
0.001
0.001
cm.丙同学的方案:通过右图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度.己称得镀锌铁皮质量为18.200g.
(4)实验所用称量仪器为
电子天平
电子天平
.(5)若改用浓盐酸,则测出锌的厚度会
偏小
偏小
(填“偏大”、“偏小”、或“无影响”).(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?
乙
乙
理由是:丙的方案中气体会带走水蒸气,易造成干扰
丙的方案中气体会带走水蒸气,易造成干扰
.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
请你帮助该同学整理并完成实验报告
(1)实验目的:
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
(4)实验结论:
(5)请用原子结构理论解释上述结论的原因
查看习题详情和答案>>
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
(1)实验目的:
证明同周期元素金属性,非金属性递变规律.(或证明第三周期元素金属性,非金属性性递变规律或证明Na、Mg、Al金属性强弱及S、Cl非金属性强弱.)
证明同周期元素金属性,非金属性递变规律.(或证明第三周期元素金属性,非金属性性递变规律或证明Na、Mg、Al金属性强弱及S、Cl非金属性强弱.)
.(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
③ ③ |
A | 2Na+2H2O=2Na++2OH-+H2↑ 2Na+2H2O=2Na++2OH-+H2↑ |
① ① |
B | 不填 |
⑤ ⑤ |
C | 不填 |
④ ④ |
D | 不填 |
② ② |
E | H2S+Cl2=2H++2Cl-+S↓ H2S+Cl2=2H++2Cl-+S↓ |
同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强
同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强
.(5)请用原子结构理论解释上述结论的原因
同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强
同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强
.乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业.乙酸苯甲酯可以用图1的设计方案合成.
(1)①的反应类型是
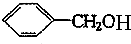
(2)写出A、C的结构简式:
 、
、

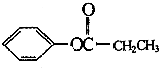
(3)D有很多同分异构体,其中属于酯且一取代苯结构的同分异构体有5个,已知其中3个的结构简式如图2:
请写出另外两个同分异构体的结构简式: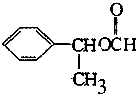
 、
、
 .
.
查看习题详情和答案>>
(1)①的反应类型是
取代反应
取代反应
、③的反应类型是取代反应
取代反应
(2)写出A、C的结构简式:




(3)D有很多同分异构体,其中属于酯且一取代苯结构的同分异构体有5个,已知其中3个的结构简式如图2:
请写出另外两个同分异构体的结构简式:





(2006?沈阳一模)为验证Na2CO3和NaHCO3的热稳定性,传统的设计方案如下:将Na2CO3和NaHCO3分别放入图(1)装置的试管中,然后加热并通过观察石灰水是否变化来验证Na2CO3和NaHCO3热稳定性;某研究性学习小组对实验装置作了如下改进:即“套管实验”,其装置如图(2)所示(加热装置未画出),请观察实验装置,分析实验原理,回答下列问题:

(1)NaHCO3受热分解的化学方程式为
(2)加热NaHCO3固体时,观察到烧杯中的现象是
(3)用套管实验时,X中应加入的药品为
(4)若检查图(2)装置的气密性,可采用
查看习题详情和答案>>

(1)NaHCO3受热分解的化学方程式为
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
(2)加热NaHCO3固体时,观察到烧杯中的现象是
出现白色浑浊
出现白色浑浊
;其离子方程式CO2+2OH-=CaCO3↓+H2O
CO2+2OH-=CaCO3↓+H2O
(3)用套管实验时,X中应加入的药品为
NaHCO3
NaHCO3
(填Na2CO3或NaHCO3),其理由是NaHCO3能在较低温度下分解
NaHCO3能在较低温度下分解
(4)若检查图(2)装置的气密性,可采用
用酒精灯微热,看两个烧杯中的导管口是否都有气泡冒出
用酒精灯微热,看两个烧杯中的导管口是否都有气泡冒出
.