摘要:6.6.5g
网址:http://m.1010jiajiao.com/timu_id_287112[举报]
 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
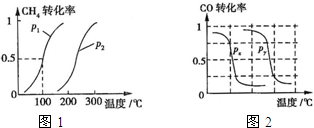
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I.CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.003mol/(L?min)
0.003mol/(L?min)
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③该反应的△H
>
>
0(填“<”、“>”或“=”).(2)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
150
150
、b=| 1 |
| 3 |
| 1 |
| 3 |
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=
0.1
0.1
MPa.羟醛缩合反应在有机合成中颇为重要,绿色催化剂的固体铌酸倍受研究者关注.铌酸具有较高的催化活性及稳定性.反应原理如下:
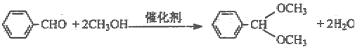
实验方法是在25mL烧瓶中加入铌酸.10mL甲醇和0.5mL甲醛,在回流状态下反应2h,反应的产率和转化率均非常高.
(1)采用回流反应2h的目的是 .
(2)在反应中甲醇需过量,其原因是 .
(3)不同铌酸用量对产率和转化率影响,如下表:
在上述苯甲醛与甲醇缩合反应实验中催化剂铌酸的最佳用量为 .
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标.铌酸催化剂循环使用次数对产率的影响如图,这说明铌酸催化剂的优点之一是 .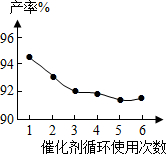
从表中得出的不同的醛与甲醇缩合反应影响转化率和产率的规律是 .
查看习题详情和答案>>

实验方法是在25mL烧瓶中加入铌酸.10mL甲醇和0.5mL甲醛,在回流状态下反应2h,反应的产率和转化率均非常高.
(1)采用回流反应2h的目的是
(2)在反应中甲醇需过量,其原因是
(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标.铌酸催化剂循环使用次数对产率的影响如图,这说明铌酸催化剂的优点之一是

| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 对羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |
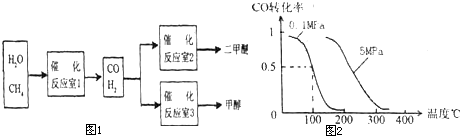
二甲醚(CH3OCH3)和甲醇(CH,OH)被称为 2l世纪的新型燃料.以CH4和H2O为原料铡备二甲醚和甲醇的工业流程如图1:
请填空:
(1)在一定条件下,反应室l中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).将1.0mol CH4和2.0mol H2O(g)通入反应室(假设容积为 100L),l0min末有0.1mol CO生成,则10min内反应的平均速率v(H2) .
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 .
(3)在压强为0.1MPa条件下,反应室3(容积为V L)中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)CO的转化率与温度、压强的关系如图2.
①该反应的△H (填“<”、“>”或“=”).
②100℃时该反应的平衡常数K= (用含a、V的代数式表示).
③在其它条件不变的情况下,反应室3再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”).
查看习题详情和答案>>

请填空:
(1)在一定条件下,反应室l中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在其它条件不变的情况下降低温度,逆反应速率将
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为
(3)在压强为0.1MPa条件下,反应室3(容积为V L)中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)CO的转化率与温度、压强的关系如图2.
①该反应的△H
②100℃时该反应的平衡常数K=
③在其它条件不变的情况下,反应室3再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
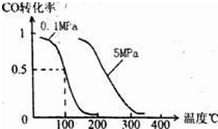 (1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0将1.0mol CH4和2.0mol H2O(g)通入该密闭容器 l0min时有0.1mol CO生成,则10min内该反应的平均速率v(H2)
0.0003mo1?L-1?min-1
0.0003mo1?L-1?min-1
.(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.
①该反应的△H
<
<
(填“<”、“>”或“=”).②100℃时该反应的平衡常数K=
| v2 |
| a2 |
| v2 |
| a2 |
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“减小”或“不变”),平衡常数不变
不变
(填“增大”、“减小”或“不变”).