题目内容
二甲醚(CH3OCH3)和甲醇(CH,OH)被称为 2l世纪的新型燃料.以CH4和H2O为原料铡备二甲醚和甲醇的工业流程如图1:
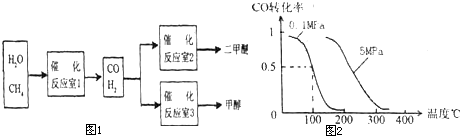
请填空:
(1)在一定条件下,反应室l中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).将1.0mol CH4和2.0mol H2O(g)通入反应室(假设容积为 100L),l0min末有0.1mol CO生成,则10min内反应的平均速率v(H2) .
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 .
(3)在压强为0.1MPa条件下,反应室3(容积为V L)中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)CO的转化率与温度、压强的关系如图2.
①该反应的△H (填“<”、“>”或“=”).
②100℃时该反应的平衡常数K= (用含a、V的代数式表示).
③在其它条件不变的情况下,反应室3再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”).

请填空:
(1)在一定条件下,反应室l中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0在其它条件不变的情况下降低温度,逆反应速率将
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为
(3)在压强为0.1MPa条件下,反应室3(容积为V L)中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)CO的转化率与温度、压强的关系如图2.
①该反应的△H
②100℃时该反应的平衡常数K=
③在其它条件不变的情况下,反应室3再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率
分析:1)温度对正逆反应速率的影响一致,升高反应速率增大,降低温度反应速率减小;
根据v=
计算出v(CO),再根据速率之比等于化学计量数之比计算v(H2).
(2)CO与H2在一定条件下,生成二甲醚和气态水,根据守恒配平写出反应方程式.
(3)①采取控制变量法分析,由图可知温度相同时,到达平衡时,压强为P2的CO转化率高,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动.
②利用三段式求出CO与H2在催化剂作用下反应生成甲醇的平衡时反应混合物各组分的浓度,代入平衡常数k=
;
③恒温恒容下,增加amolCO与2amolH2,CO与H2的比例与原平衡相同,等效为增大压强,平衡向体积减小的方向移动,即向正反应移动;
平衡常数只受温度影响,温度不变,平衡常数不变.
根据v=
| △n |
| △t |
(2)CO与H2在一定条件下,生成二甲醚和气态水,根据守恒配平写出反应方程式.
(3)①采取控制变量法分析,由图可知温度相同时,到达平衡时,压强为P2的CO转化率高,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动.
②利用三段式求出CO与H2在催化剂作用下反应生成甲醇的平衡时反应混合物各组分的浓度,代入平衡常数k=
| c(CH3OH) |
| c(CO)c2(H2) |
③恒温恒容下,增加amolCO与2amolH2,CO与H2的比例与原平衡相同,等效为增大压强,平衡向体积减小的方向移动,即向正反应移动;
平衡常数只受温度影响,温度不变,平衡常数不变.
解答:解:(1)温度对正逆反应速率的影响一致,降低温度反应速率减小;
v(CO)=
=0.0001mol?L-1?min-1,
速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001mol?L-1?min-1=0.0003mol?L-1?min-1,
故答案为:减小;0.0003mol?L-1?min-1;
(2)CO与H2在一定条件下,生成二甲醚和气态水,反应方程式为2CO+4H2
CH3OCH3+H2O,
故答案为:2CO+4H2
CH3OCH3+H2O
(3))①由图可知温度相同时,到达平衡时,压强为P2的CO转化率高,平衡向正反应方向移动,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动,即P1<P2,故答案为:<;
②利用三段式求出CO与H2在催化剂作用下反应生成甲醇的平衡时反应混合物各组分的浓度,由图可知100℃时,达到平衡时,CO的转化率为0.5,则
CO(g)+2H2(g)?CH3OH(g),
开始(mol/L):
2
0
变化(mol/L):0.5
0.5
平衡(mol/L):0.5
0.5
代入平衡常数k=
=
=
,反应的平衡常数为=
,
故答案为:
;
③恒温恒容下,增加amolCO与2amolH2,CO与H2的比例与原平衡相同,等效为增大压强,平衡向体积减小的方向移动,即向正反应移动,CO的转化率增大;
平衡常数只受温度影响,温度不变,平衡常数不变,
故答案为:增大;不变.
v(CO)=
| ||
| 10min |
速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001mol?L-1?min-1=0.0003mol?L-1?min-1,
故答案为:减小;0.0003mol?L-1?min-1;
(2)CO与H2在一定条件下,生成二甲醚和气态水,反应方程式为2CO+4H2
| ||
故答案为:2CO+4H2
| ||
(3))①由图可知温度相同时,到达平衡时,压强为P2的CO转化率高,平衡向正反应方向移动,反应为气体体积减小的反应,增大压强平衡向体积减小的方向移动,即P1<P2,故答案为:<;
②利用三段式求出CO与H2在催化剂作用下反应生成甲醇的平衡时反应混合物各组分的浓度,由图可知100℃时,达到平衡时,CO的转化率为0.5,则
CO(g)+2H2(g)?CH3OH(g),
开始(mol/L):
| a |
| V |
| a |
| V |
变化(mol/L):0.5
| a |
| V |
| a |
| V |
| a |
| V |
平衡(mol/L):0.5
| a |
| V |
| a |
| V |
| a |
| V |
代入平衡常数k=
| c(CH3OH) |
| c(CO)c2(H2) |
| ||||
|
| V2 |
| a2 |
| V2 |
| a2 |
故答案为:
| V2 |
| a2 |
③恒温恒容下,增加amolCO与2amolH2,CO与H2的比例与原平衡相同,等效为增大压强,平衡向体积减小的方向移动,即向正反应移动,CO的转化率增大;
平衡常数只受温度影响,温度不变,平衡常数不变,
故答案为:增大;不变.
点评:本题考查化学反应速率计算、平衡移动、平衡常数等,难度中等,注意三段式解题法的运用,反应速率的计算既可利用定义法也可利用化学计量数法.

练习册系列答案
相关题目

 CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。
 与H2合成二甲醚的化学方程式为 .
与H2合成二甲醚的化学方程式为 . CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) ×100%,试求反应(Ⅳ)的原子利用率为 。
×100%,试求反应(Ⅳ)的原子利用率为 。