题目内容
 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
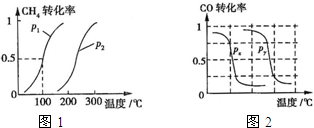
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I.CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.003mol/(L?min)
0.003mol/(L?min)
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③该反应的△H
>
>
0(填“<”、“>”或“=”).(2)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
150
150
、b=| 1 |
| 3 |
| 1 |
| 3 |
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=
0.1
0.1
MPa.分析:(1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=
计算v(CH4),利用速率之比等于化学计量数之比计算v(H2).
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
平衡常数k=
,计算出平衡时,各组分的浓度,代入平衡常数计算.
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移.
(2)①容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析.
②采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断a、b的值.
③根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断.
| △c |
| △t |
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
平衡常数k=
| c(CO)×[c(H2)]3 |
| c(CH4)×c(H2O) |
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移.
(2)①容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析.
②采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断a、b的值.
③根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断.
解答:解:(1)①由图知道平衡时甲烷的转化率为0.5,所以△c(CH4)
=0.005mol/L,
所以v(CH4)=
=0.001mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(CH4)=3×0.001mol/(L?min)=0.003mol/(L?min).
故答案为:0.003mol/(L?min).
②温度相同时,作垂直x轴的辅助线,发现压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2.
CH4(g)+H2O(g) CO(g)+3H2(g),
CO(g)+3H2(g),
开始(mol):1.0 2.0 0 0
变化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常数k=
=
=2.25×10-4,
故答案为:<;2.25×10-4
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移,温度升高平衡向吸热方向移动,所以正反应为吸热反应,即△H>0.
故答案为:>
(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故选:BD
②A、采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,
应保持不变,所以b=
;比较使用1、2,压强不同,所以温度应相同,故a=150.
故答案为:a=150;b=
B、温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强Px=0.1MPa.
故答案为:0.1
| 1.0mol×0.5 |
| 100L |
所以v(CH4)=
| 0.005mol/L |
| 5min |
故答案为:0.003mol/(L?min).
②温度相同时,作垂直x轴的辅助线,发现压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2.
CH4(g)+H2O(g)
 CO(g)+3H2(g),
CO(g)+3H2(g),开始(mol):1.0 2.0 0 0
变化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常数k=
| c(CO)×[c(H2)]3 |
| c(CH4)×c(H2O) |
| ||||
|
故答案为:<;2.25×10-4
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移,温度升高平衡向吸热方向移动,所以正反应为吸热反应,即△H>0.
故答案为:>
(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故选:BD
②A、采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,
| n(CO) |
| n(H2) |
| 1 |
| 3 |
故答案为:a=150;b=
| 1 |
| 3 |
B、温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强Px=0.1MPa.
故答案为:0.1
点评:本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力等,综合性较大,难度中等,知识面广,应加强平时知识的积累.注意控制变量法与定一议二原则应用.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目



