摘要:在0.6≤x≤1内.总沉淀量为0.04mol.
网址:http://m.1010jiajiao.com/timu_id_286640[举报]
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.回答下列问题:
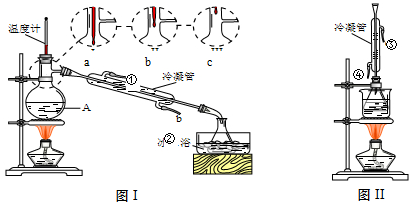
(1)米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是 ;A中温度计的位置正确的是 (选填a、b或c);
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是 .欲收集无水乙醇,可加入足量的 (填物质名称)后再进行蒸馏.
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是 .若该白酒样品为优质级,则消耗NaOH溶液体积应不小于 mL.
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是 .已知最终消耗硫酸标准溶液7.70mL,该白酒样品中总酯量为 g/L.
(5)下列操作会使总酯量测定结果偏高的是 (选填编号)
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为 (选填编号)
a.①③b.②④c.②③d.①④ 查看习题详情和答案>>

(1)米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是
(5)下列操作会使总酯量测定结果偏高的是
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为
a.①③b.②④c.②③d.①④ 查看习题详情和答案>>
食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.某研究性学习小组欲测定市售食醋总酸含量,设计如下实验步骤.
用移液管移取10mL市售食醋,置于100mL容量瓶中,加水稀释至刻度线,从中取出食醋溶液20mL于锥形瓶中,并滴加
(1)把上述步骤中的两处空白补充完整.
(2)①该市售食醋的总酸量为
②下列操作会导致所测食醋中总酸含量偏高的是
A、配制醋酸溶液时,加水超过刻度线,用吸管吸出.
B、碱式滴定管未用标准NaOH溶液润洗
C、读取NaOH溶液体积时,初读数时仰视,终读数时俯视
D、装食醋溶液的锥形瓶未用食醋溶液润洗
(3)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
a.pH b.电离度 c.电离常数 d.溶解度
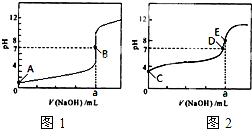
(4)常温下,用0.1000mol?L-1NaOH溶液分别滴定20.00mL 0.1000mol?L-1HCl溶液和20.00mL 0.1000mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
②E点pH>8的原因用离子方程式表示
查看习题详情和答案>>
用移液管移取10mL市售食醋,置于100mL容量瓶中,加水稀释至刻度线,从中取出食醋溶液20mL于锥形瓶中,并滴加
酚酞
酚酞
2-3滴.将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置后,读取数据,记录为NaOH标准溶液体积的初读数.用0.1000mol?L-NaOH标准溶液进行滴定,当看到溶液的颜色由无色变浅红且保持30秒内不褪色
溶液的颜色由无色变浅红且保持30秒内不褪色
时,停止滴定,记录NaOH的终读数.重复滴定3次.实验有关数据如表所示:| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(醋酸溶液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
(2)①该市售食醋的总酸量为
4.50
4.50
(g/100mL).是否合格?是
是
(_填“是”或“否”).②下列操作会导致所测食醋中总酸含量偏高的是
B
B
.A、配制醋酸溶液时,加水超过刻度线,用吸管吸出.
B、碱式滴定管未用标准NaOH溶液润洗
C、读取NaOH溶液体积时,初读数时仰视,终读数时俯视
D、装食醋溶液的锥形瓶未用食醋溶液润洗
(3)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
c
c
(填写序号).a.pH b.电离度 c.电离常数 d.溶解度
(4)常温下,用0.1000mol?L-1NaOH溶液分别滴定20.00mL 0.1000mol?L-1HCl溶液和20.00mL 0.1000mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
图2
图2
(填“图l”或“图2”);滴定曲线中a=20.00
20.00
mL;②E点pH>8的原因用离子方程式表示
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
.食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-═H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol/L,则该食醋的总酸量为4.5g/100mL
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HCl溶液和20.00mL 0.1000mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示.
①滴定醋酸溶液的曲线是
②E点pH>8的原因用离子方程式表示
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(5)NaOH溶液滴定CH3COOH溶液,选用
查看习题详情和答案>>
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是
bd
bd
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-═H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol/L,则该食醋的总酸量为4.5g/100mL
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
c
c
(填写序号).a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 HCl溶液和20.00mL 0.1000mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
图2
图2
(填“图1”或“图2”);滴定曲线中a=20
20
mL;②E点pH>8的原因用离子方程式表示
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
.(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是
d
d
.a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(5)NaOH溶液滴定CH3COOH溶液,选用
酚酞
酚酞
作指示剂,终点的现象为由无色变粉红色,且半分钟内不恢复原色
由无色变粉红色,且半分钟内不恢复原色
;若装待测液的锥形瓶未用待装液润洗,则测的醋酸的含量无影响
无影响
(填“偏高”、“偏低”或“无影响”)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO.其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如图所示.
在B容器中生成硝酸的物质的量为
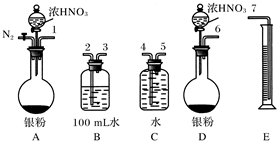
(2)测定NO的体积
①从图所示的装置中,你认为应选用
②选用图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
③在读取量筒内液体体积之前,应进行的操作
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中
查看习题详情和答案>>

(1)测定硝酸的物质的量反应结束后,从如图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如图所示.
在B容器中生成硝酸的物质的量为
0.008mol
0.008mol
,则Ag与浓硝酸反应过程中生成的NO2的物质的量为0.012mol
0.012mol
.
(2)测定NO的体积
①从图所示的装置中,你认为应选用
A
A
装置进行Ag与浓硝酸反应实验,选用的理由是因为A装置可以通入N2将装置中的空气排尽,防止NO被空气中O2氧化
因为A装置可以通入N2将装置中的空气排尽,防止NO被空气中O2氧化
.②选用图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
123547
123547
(填各导管口编号).③在读取量筒内液体体积之前,应进行的操作
等液体冷却到室温,并使集气瓶和量筒内液面相平
等液体冷却到室温,并使集气瓶和量筒内液面相平
.(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中
有
有
(填“有”或“没有”)NO产生,作此判断的依据是因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
. 2C(g) + xD(g)。若经10s后测得生成2 molC,D的浓度为0.5 mol·L-1,下列几种说法正确的是
2C(g) + xD(g)。若经10s后测得生成2 molC,D的浓度为0.5 mol·L-1,下列几种说法正确的是