题目内容
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.回答下列问题: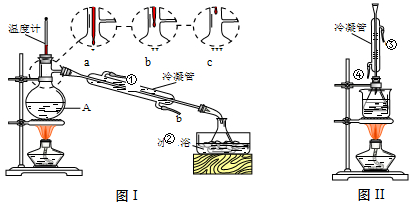
(1)米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是
(5)下列操作会使总酯量测定结果偏高的是
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为
a.①③b.②④c.②③d.①④
分析:(1)蒸馏时用蒸馏烧瓶,温度计水银球位置在支管口处;
(2)从乙醇的性质分析;乙醇和乙酸易挥发,水也易挥发,故加入生石灰和乙酸反应吸收水;
(3)当滴定终点时,溶液显碱性,酚酞由无色变为粉红色,根据优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L计算需要氢氧化钠的体积;
(4)加热促进水解,根据消耗硫酸量来计算和硫酸反应的氢氧化钠的量,从而可计算出酯水解需要碱的量,进而计算出酯的量;
(5)根据消耗酸的量来确定误差,若耗酸多,则计算出的酯量少,偏低,反之偏高,据此分析;
(6)冷凝水从下口进上口出.
(2)从乙醇的性质分析;乙醇和乙酸易挥发,水也易挥发,故加入生石灰和乙酸反应吸收水;
(3)当滴定终点时,溶液显碱性,酚酞由无色变为粉红色,根据优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L计算需要氢氧化钠的体积;
(4)加热促进水解,根据消耗硫酸量来计算和硫酸反应的氢氧化钠的量,从而可计算出酯水解需要碱的量,进而计算出酯的量;
(5)根据消耗酸的量来确定误差,若耗酸多,则计算出的酯量少,偏低,反之偏高,据此分析;
(6)冷凝水从下口进上口出.
解答:解:(1)蒸馏时用蒸馏烧瓶,温度计水银球位置在支管口处,以便于测量流出蒸气的温度,
故答案为:蒸馏烧瓶;温度计水银在支管处,即在b处;
(2)乙醇易挥发,为了减少乙醇的挥发,采用冰水冷凝的方法;乙醇和乙酸易挥发,水也易挥发,故加入生石灰和乙酸反应吸收水;
故答案为:减少乙醇挥发,防止影响测定结果(作用是冷凝);生石灰;
(3)当滴定终点时,溶液显碱性,酚酞由无色变为粉红色;根据优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,
则20.00mL样品含乙酸:0.02L×0.30g/L=0.006g,
CH3COOH+NaOH=CH3COONa+H2O
60g 1mol
0.006g 0.01V
=
,解得V=0.01L=10mL;
故答案为:溶液由无色变为粉红色,半分钟内不褪色;10;
(4)加热可促进酯的水解速率,使酯水解完全;滴定耗硫酸的物质的量:0.1mol/L×7.7mL=0.77mmol,中和氢氧化钠的物质的量为:0.77mmol×2=1.54mmol,
酯水解消耗氢氧化钠物质的量为:20.00mL×0.100mol/L-1.54mmol=0.46mmol,故酯的物质的量为0.46mmol,质量为:0.46mmol×88g/mol=40.48mg,
故该样品总酯量为:
=2.024g/L,故答案为:使酯水解完全;2.024;
(5)根据消耗酸的量来确定误差,若耗酸多,则计算出的酯量少,偏低,反之偏高.
a.加热时未使用水浴和冷凝管,酯挥发结果偏低;
b.甲基橙变色范围为3.1-4.4,在酸性范围内变色,酸消耗多,结果偏低;
c.滴定前滴定管内无气泡,滴定后产生气泡,酸消耗体积读数偏小,结果偏高;
d.滴定管未用硫酸标准溶液润洗,耗酸多,结果偏低;
故选c;
(6)冷凝水从下口进上口出,故选b.
故答案为:蒸馏烧瓶;温度计水银在支管处,即在b处;
(2)乙醇易挥发,为了减少乙醇的挥发,采用冰水冷凝的方法;乙醇和乙酸易挥发,水也易挥发,故加入生石灰和乙酸反应吸收水;
故答案为:减少乙醇挥发,防止影响测定结果(作用是冷凝);生石灰;
(3)当滴定终点时,溶液显碱性,酚酞由无色变为粉红色;根据优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,
则20.00mL样品含乙酸:0.02L×0.30g/L=0.006g,
CH3COOH+NaOH=CH3COONa+H2O
60g 1mol
0.006g 0.01V
| 60g |
| 0.006g |
| 1mol |
| 0.01V |
故答案为:溶液由无色变为粉红色,半分钟内不褪色;10;
(4)加热可促进酯的水解速率,使酯水解完全;滴定耗硫酸的物质的量:0.1mol/L×7.7mL=0.77mmol,中和氢氧化钠的物质的量为:0.77mmol×2=1.54mmol,
酯水解消耗氢氧化钠物质的量为:20.00mL×0.100mol/L-1.54mmol=0.46mmol,故酯的物质的量为0.46mmol,质量为:0.46mmol×88g/mol=40.48mg,
故该样品总酯量为:
| 40.48mg |
| 20mL |
(5)根据消耗酸的量来确定误差,若耗酸多,则计算出的酯量少,偏低,反之偏高.
a.加热时未使用水浴和冷凝管,酯挥发结果偏低;
b.甲基橙变色范围为3.1-4.4,在酸性范围内变色,酸消耗多,结果偏低;
c.滴定前滴定管内无气泡,滴定后产生气泡,酸消耗体积读数偏小,结果偏高;
d.滴定管未用硫酸标准溶液润洗,耗酸多,结果偏低;
故选c;
(6)冷凝水从下口进上口出,故选b.
点评:本题以乙醇的制法为依托,考查了利用中和滴定探究物质的含量,较难.解题关键是搞清反应原理,根据中和滴定的数据进行计算.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目