网址:http://m.1010jiajiao.com/timu_id_285217[举报]
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 737 | 1451 | 7733 | 10540 |

(2)金属钛被称为铁和铝之后崛起的第三金属,Ti原子的电子排布式为
(3)在①SiO32-、②SO32-、③CH3OH、④CS2、⑤CCl4五种微粒中,中心原子采取sp3杂化的有
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 737 | 1451 | 7733 | 10540 |
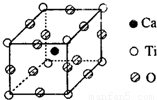
(2)金属钛被称为铁和铝之后崛起的第三金属,Ti原子的电子排布式为______;右图为高温超导领域中的一种化合物钙-钛钙(氧化物)晶体结构中蛤有代表性的最小重复单元,在该晶体中每个钛离子周围与它最近且距离相等的钛离子有______个.该晶体的化学式为______;
(3)在①SiO32-、②SO32-、③CH3OH、④CS2、⑤CCl4五种微粒中,中心原子采取sp3杂化的有______(填序号).
 查看习题详情和答案>>
查看习题详情和答案>>
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
查看习题详情和答案>>
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离能 ( kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
查看习题详情和答案>>
【制备】下列是该小组同学设计的实验装置1.回答下列问题:
(1)装置中长导管的主要作用是
(2)证明锥形瓶中收集到乙酸乙酯的简单方法是
【分离】锥形瓶中得到的产物是混合物,为了分离该混合物,设计了如下流程2:
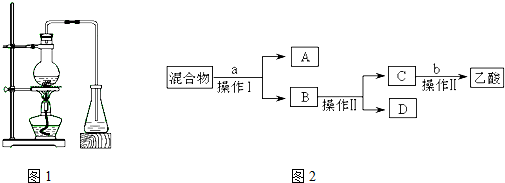
(3)a试剂最好选用
(4)操作Ⅰ、操作Ⅱ分别是
A.过滤、分液 B.萃取、蒸馏 C.分液、蒸馏 D.过滤、蒸发.