题目内容
【化学-物质结构与性质】(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 737 | 1451 | 7733 | 10540 |
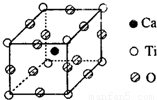
(2)金属钛被称为铁和铝之后崛起的第三金属,Ti原子的电子排布式为______;右图为高温超导领域中的一种化合物钙-钛钙(氧化物)晶体结构中蛤有代表性的最小重复单元,在该晶体中每个钛离子周围与它最近且距离相等的钛离子有______个.该晶体的化学式为______;
(3)在①SiO32-、②SO32-、③CH3OH、④CS2、⑤CCl4五种微粒中,中心原子采取sp3杂化的有______(填序号).
【答案】分析:(1)由电离能可知,A可失去3个电子,B可失去2个电子,则A为Al,B为Mg;
(2)Ti的原子序数为22,根据能量最低原理书写电子排布式,利用均摊法计算晶胞的结构;
(3)根据各物质的价层电子对判断杂化类型.
解答:解:(1)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则A为Al,B为Mg,同周期元素从左到右元素的电负性逐渐增强,则电负性A>B,
故答案为:+3;>;
(2)Ti的原子序数为22,电子排布式为1s22s22p63s23p64s2,由晶胞结构可知,该晶体中每个钛离子周围与它最近且距离相等的钛离子有6个,晶胞中,Ca位于体心,为1个,Ti位于顶点,含有8× =1,O位于棱,含有12×
=1,O位于棱,含有12× =3,
=3,
则化学式为CaTiO3,
故答案为:1s22s22p63s23p64s2;6;CaTiO3;
(3)在①SiO32-中心原子的价层电子对为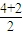 =3,为sp2杂化;
=3,为sp2杂化;
②SO32-中心原子的价层电子对为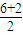 =4,为sp3杂化;
=4,为sp3杂化;
③CH3OH中心原子形成4个δ键,为sp3杂化;
④CS2中心原子形成2个δ键,为sp杂化;
⑤CCl4中心原子形成4个δ键,为sp3杂化,
故答案为:②③⑤.
点评:本题考查晶胞的计算,电负性、电离能以及杂化类型的判断等问题,题目综合性较强,难度较大,本题中注意把握晶胞的分析和杂化类型的判断方法.
(2)Ti的原子序数为22,根据能量最低原理书写电子排布式,利用均摊法计算晶胞的结构;
(3)根据各物质的价层电子对判断杂化类型.
解答:解:(1)由电离能可知,A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则A为Al,B为Mg,同周期元素从左到右元素的电负性逐渐增强,则电负性A>B,
故答案为:+3;>;
(2)Ti的原子序数为22,电子排布式为1s22s22p63s23p64s2,由晶胞结构可知,该晶体中每个钛离子周围与它最近且距离相等的钛离子有6个,晶胞中,Ca位于体心,为1个,Ti位于顶点,含有8×
 =1,O位于棱,含有12×
=1,O位于棱,含有12× =3,
=3,则化学式为CaTiO3,
故答案为:1s22s22p63s23p64s2;6;CaTiO3;
(3)在①SiO32-中心原子的价层电子对为
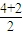 =3,为sp2杂化;
=3,为sp2杂化;②SO32-中心原子的价层电子对为
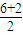 =4,为sp3杂化;
=4,为sp3杂化;③CH3OH中心原子形成4个δ键,为sp3杂化;
④CS2中心原子形成2个δ键,为sp杂化;
⑤CCl4中心原子形成4个δ键,为sp3杂化,
故答案为:②③⑤.
点评:本题考查晶胞的计算,电负性、电离能以及杂化类型的判断等问题,题目综合性较强,难度较大,本题中注意把握晶胞的分析和杂化类型的判断方法.

练习册系列答案
相关题目
 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】
 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】 【化学-物质结构与性质】
【化学-物质结构与性质】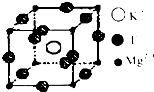 【化学--物质结构与性质】
【化学--物质结构与性质】