网址:http://m.1010jiajiao.com/timu_id_271809[举报]
一、选择题答案。(每小题3分,共48分)
1―8 CDCBDBCA 9―16 BADCAABC

二、非选择题答案。(52分)
17.(7分)(1) (2分) (2)
(3)CD (2分)
(2分) (2)
(3)CD (2分)
 18.(共18分)
18.(共18分)
(1)H C(每个1分,共3分)
(2)C (1分) (3) (4)1 (2分)
(5)① (2分)
(2分)
②促进(1分)。  (2分)
③ab(3分)
(2分)
③ab(3分)
(6) 或其他合理答案(3分)
或其他合理答案(3分)
19.(14分)(1)10 (2分);
11(2分)
(2分);
11(2分)
(2) (2分);(写出后者即给2分)
(2分);(写出后者即给2分)
 (2分)
(2分)
(3) 1:9 (3分)
(4)a+b=13(3分)
20.(13分)(1) (2分)
(2分)
(2)分液漏斗上口的塞子未打开(或漏斗未与大气相通或漏斗塞子的凹槽未与颈部的通气孔对准(1分)
(3)④(2分) (4)
(5)①关闭K ,在烧杯中用水封住玻璃导管口,用手捂住集气瓶b,烧杯用导管口有气泡产生,松手后,导管内有一段液柱保持不降则气密性好(3分)
,在烧杯中用水封住玻璃导管口,用手捂住集气瓶b,烧杯用导管口有气泡产生,松手后,导管内有一段液柱保持不降则气密性好(3分)
②打开K ,关闭K
,关闭K ,点燃酒精灯。(2分)
,点燃酒精灯。(2分)
(14分)水的离子积常数K![]() 与温度t(℃)的关系如右图所示:
与温度t(℃)的关系如右图所示:

(1)若![]() ℃,则K
℃,则K![]() =_________;若
=_________;若![]() ℃时,则100℃时,0.05
℃时,则100℃时,0.05![]() 的Ba(OH)
的Ba(OH)![]() 溶液的pH=__________。
溶液的pH=__________。
(2)已知25℃时,![]() 的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(离子方程式表示):__________。溶液中各离子的物质的量浓度由大到小的顺序为___________。
的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(离子方程式表示):__________。溶液中各离子的物质的量浓度由大到小的顺序为___________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为____________________。
(4)100℃时,若10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为:_______________。
查看习题详情和答案>>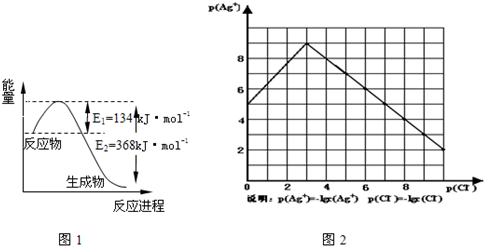
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为
υ(N2)(正)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
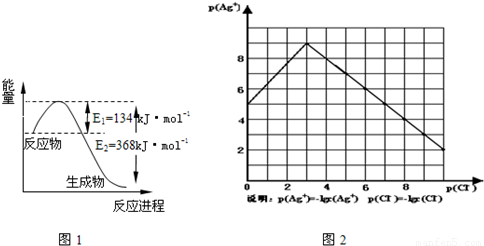
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 . 查看习题详情和答案>>
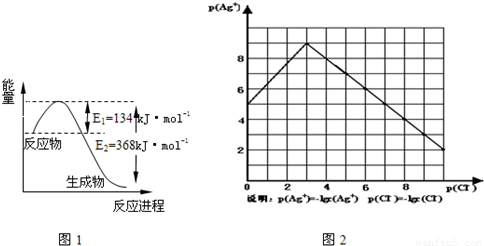
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1 K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为 .当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正) υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为 .
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是 .
(4)若在AgCl形成的浊液中滴加氨水有什么现象? .发生反应的离子方程式为 . 查看习题详情和答案>>
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1
②判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式
 [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+②盐酸肼水溶液中离子浓度的排列顺序正确的是
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])>c(H+)>c(OH-)
C.c(N2H62+)+c([N2H5?H2O+])+c(H+)=c(Cl-)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注.查资料得知Pb4+具有很强的氧化性.水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
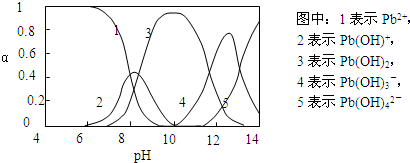
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为