网址:http://m.1010jiajiao.com/timu_id_259963[举报]
一、单项选择题(45分)
1.D 2.B 3.A 4.C 5.B 6.B 7.C 8.A 9.D 10.B 11.C 12.B 13.D 14.D 15.A
二、(27分
16.(6分)(1)0.05mol?L-1?s-1 (2分)
(2)0.05mol(2分) (3).files/image291.gif) (2分)
(2分)
17.(9分)(1)碱(1分).files/image293.gif) (2分
(2分
(2).files/image295.gif) (2分,只写离子符号不得分)
(2分,只写离子符号不得分)
(3)④ ⑤ ③ ② ①(2分)
(4)NAOH完全电离(1分),.files/image030.gif) 水解是可逆反应,反应进行不彻底(1分)
水解是可逆反应,反应进行不彻底(1分)
18.(12分)(1).files/image298.gif)
.files/image300.gif)
.files/image112.gif)
.files/image303.gif) (各1分,写物质名称也可给分)
(各1分,写物质名称也可给分)
(2).files/image305.gif) =====
=====.files/image307.gif) (3分)
(3分)
.files/image309.gif) =====
=====.files/image311.gif) (3分)
(3分)
(3) .files/image313.gif)
.files/image108.gif) (2分,各1分)
(2分,各1分)
三、(22分)19.(11分)(1).files/image316.gif)
.files/image318.gif)
.files/image320.gif) (2分)
(2分)
.files/image322.gif)
.files/image261.gif) (2分,各1分)红棕色褪去(1分) 加成(1分)
(2分,各1分)红棕色褪去(1分) 加成(1分)
(2)分液漏斗(1分).files/image325.gif) (2分)
(2分)
(3).files/image326.gif) (2分)
(2分)
20.(11分)(1)铁丝在氯气中燃烧,生成棕黄色的烟(3分)
黄(2分) 抑制.files/image328.gif) 水解(3分),答防止
水解(3分),答防止.files/image328.gif) 水解扣1分)
水解扣1分)
(2).files/image330.gif) =====
=====.files/image332.gif) (3分)
(3分)
四、(6分)21.(6分)0.75mol?L-1或0.95 mol?L-1(各3分)
B卷
五、(16分)
22.C 23.D 24.D 25.B 26.C 27.A 28.D 29.B
六、(28分)30.(4分)(1).files/image334.gif) +
+ .files/image336.gif) =====
===== .files/image338.gif) (2分)
(2分)
(2).files/image340.gif) =====
===== .files/image342.gif) (2分)
(2分)
31.(8分)(1).files/image344.gif)
.files/image346.gif)
.files/image046.gif) (3分,各1分,有错扣1分)
(3分,各1分,有错扣1分)
.files/image349.gif) 或
或.files/image351.gif) (2分,其他合理答案也可给分)
(2分,其他合理答案也可给分)
(2).files/image353.gif) (1分)
(1分).files/image355.gif) 第一步电离产生的
第一步电离产生的.files/image245.gif) 抑制了
抑制了.files/image346.gif) 的电离(2分)
的电离(2分)
32.(4分)(1)A (2分) (2)5:4 (2分)
33.(12分)(1).files/image112.gif) (2分) 受热分解生成
(2分) 受热分解生成.files/image360.gif) (2分) c点(2分)
(2分) c点(2分)
得到较高温度水蒸气(1),并排出装置中残留的空气,防止铁粉被氧化(1)
(2).files/image280.gif) ====
====.files/image363.gif) (2分)
(2分)
.files/image365.gif) =====
=====.files/image367.gif) (2分)
(2分)
七、(6分)34.(6分)(1)10:1(2分) (2)2(2分) (3)101:9 (2分)
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。

| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度
③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。
查看习题详情和答案>>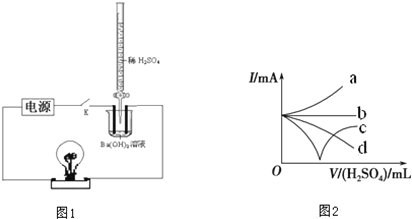
(1)该小组按图1连好装置后,接通开关K,旋转滴定管活塞使稀H2SO4缓缓滴下直至过量.图1装置中观察到的现象是
(2)写出该反应的离子方程式
(3)下列三种情况下,与(2)中离子方程式相同的是
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(4)步骤(1)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的
 (2010?定海区模拟)I.(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
(2010?定海区模拟)I.(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是(2)若室温下pH=2的盐酸和醋酸溶液各100mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则:V1
II.已知常温下,Cu(OH)2 的溶度积常数为Ksp=2×10 -20.又知常温下某CuSO4溶液里 Cu2+浓度为0.02mol?L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
III.常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈
 (08上海闽行区模拟) (B)(12分)(1)某同学用托盘天平称量8.0gNaOH固体,则需先称量一个烧杯的质量,用“↓”表示在托盘天平上放上砝码,用“↑”表示在托盘天平上取下砝码,称量过程如右图所示,此时天平平衡,则烧杯的质量为_________g;在右盘再放________g砝码,将游码移至______g位置,然后向烧杯中加入NaOH固体,直至天平平衡。
(08上海闽行区模拟) (B)(12分)(1)某同学用托盘天平称量8.0gNaOH固体,则需先称量一个烧杯的质量,用“↓”表示在托盘天平上放上砝码,用“↑”表示在托盘天平上取下砝码,称量过程如右图所示,此时天平平衡,则烧杯的质量为_________g;在右盘再放________g砝码,将游码移至______g位置,然后向烧杯中加入NaOH固体,直至天平平衡。
(2)常见的粗盐主要含有NaCl和少量的MgCl2、CaCl2,由于有MgCl2和CaCl2的存在,使得食盐容易板结,下面实验可以确定粗盐中NaCl的质量分数,也可以制得纯净的NaCl,实验步骤如下:
①调整托盘天平零点
②称取样品W克
③将样品溶解于适量的蒸馏水
④滴加稍过量的A溶液,有沉淀产生,沉淀完全后过滤
⑤将得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W1克
⑥滤液中加入稍过量的B溶液,又待沉淀完全后过滤
⑦将⑥得到的滤渣用蒸馏水多次洗涤,烘干,得纯净固体W2克
⑧在最后得的滤液中加入稍过量C溶液,加热蒸发溶剂得到纯净![]() 固体W3克
固体W3克
请根据要求回答问题:
① 加入的试剂A是 ,B是 ,C是 。
②检验步骤④中A是否过量的方法是 。
③两次洗涤沉淀,为了检验沉淀是否洗净,应在最后几滴洗出液中加入 ,若 表示沉淀已洗净。
④ 该粗盐中![]() 的质量分数的计算式是 。
的质量分数的计算式是 。
莫尔是一位著名分析化学家,以他命名的莫尔盐[ (NH4)2Fe(SO4)2?6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用。某同学模拟制备莫尔盐并利用莫尔盐测定高锰酸钾溶液的浓度。他的实验过程如下:
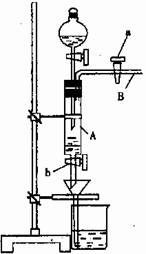
A中放有2g废铁屑(含铁锈,其他杂质不与稀硫酸反应),烧杯中盛有饱和硫酸铵溶液,实验时打开a,关闭b,从分液漏斗内向A中加一定量的稀硫酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水,再降温结晶获得莫尔盐晶体。然后用莫尔盐测定未知高锰酸钾溶液的浓度。
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式是
。
(2)滴加稀H2SO4时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是
。
(3)取3.92g莫尔盐晶体配成100mL溶液,用酸式滴定管取20.00mL注入锥形瓶中,然后用未知浓度的酸性高锰酸钾溶液进行滴定,消耗该溶液的体积为8.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ ― Mn2++ Fe3++ H2O
②用 (酸式或碱式)滴定管盛装高锰酸钾溶液
③高锰酸钾溶液的物质的量浓度是 。
查看习题详情和答案>>