题目内容
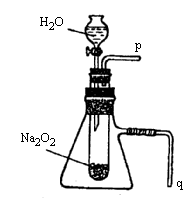
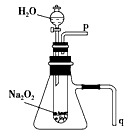
某学习小组拟设计如图1所示实验装置验证Ba(OH)2溶液和H2SO4溶液发生的是离子反应(夹持仪器略去).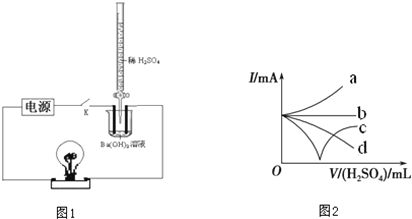
(1)该小组按图1连好装置后,接通开关K,旋转滴定管活塞使稀H2SO4缓缓滴下直至过量.图1装置中观察到的现象是
(2)写出该反应的离子方程式
(3)下列三种情况下,与(2)中离子方程式相同的是
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(4)步骤(1)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的
分析:(1)导电微粒的浓度越大,灯泡的亮度越大;
(2)注意离子方程式遵循电荷守恒定律;
(3)A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要1molBa(OH)2;
B.1molNaHSO4加入Ba(OH)2溶液0.5mol至溶液显中性;
C.用数值假设法确定,假设NaHSO4为1mol,使原溶液中的氢离子和SO42-恰好完全沉淀,需要Ba(OH)21mol;
(4)导电微粒的浓度越大,灯泡的亮度越大,导电能力越强.
(2)注意离子方程式遵循电荷守恒定律;
(3)A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要1molBa(OH)2;
B.1molNaHSO4加入Ba(OH)2溶液0.5mol至溶液显中性;
C.用数值假设法确定,假设NaHSO4为1mol,使原溶液中的氢离子和SO42-恰好完全沉淀,需要Ba(OH)21mol;
(4)导电微粒的浓度越大,灯泡的亮度越大,导电能力越强.
解答:解:(1)开始氢氧化钡电离出氢氧根和钡离子导电,随反应进行,反应生成硫酸钡沉淀和水,溶液中无导电微粒,灯泡熄灭,继续加入硫酸,硫酸电离出氢离子和硫酸根导电,导电微粒的浓度越大,灯泡的亮度越大,
故答案为:烧杯中出现白色沉淀;灯泡由明变暗,直至熄灭,然后又逐渐变亮;实验过程中灯泡的亮度发生变化,说明离子浓度发生变化,则该反应为离子反应;
(2)氢氧化钡与硫酸反应生成硫酸钡和水,反应的离子方程式Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故答案为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;
(3)A.假设NaHSO4为1mol,使原溶液中的SO42-恰好完全沉淀,需要Ba(OH)21mol,则发生反应的离子的物质的量分别为1mol,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故A错误;
B.1molNaHSO4加入Ba(OH)2溶液0.5mol至溶液显中性,离子方程式Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故B正确;
C.假设NaHSO4为1mol,使原溶液中的氢离子和SO42-恰好完全沉淀,需要Ba(OH)21mol,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C错误;
故答案为:B;
(4)导电微粒的浓度越大,灯泡的亮度越大,导电能力越强,即先减小再增大,故答案为:C.
故答案为:烧杯中出现白色沉淀;灯泡由明变暗,直至熄灭,然后又逐渐变亮;实验过程中灯泡的亮度发生变化,说明离子浓度发生变化,则该反应为离子反应;
(2)氢氧化钡与硫酸反应生成硫酸钡和水,反应的离子方程式Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故答案为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O;
(3)A.假设NaHSO4为1mol,使原溶液中的SO42-恰好完全沉淀,需要Ba(OH)21mol,则发生反应的离子的物质的量分别为1mol,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故A错误;
B.1molNaHSO4加入Ba(OH)2溶液0.5mol至溶液显中性,离子方程式Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故B正确;
C.假设NaHSO4为1mol,使原溶液中的氢离子和SO42-恰好完全沉淀,需要Ba(OH)21mol,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C错误;
故答案为:B;
(4)导电微粒的浓度越大,灯泡的亮度越大,导电能力越强,即先减小再增大,故答案为:C.
点评:本题考查溶液的导电能力和离子方程式的书写,题目难度较大,注意与量有关的离子方程式的书写方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目