网址:http://m.1010jiajiao.com/timu_id_258349[举报]
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
D
A
D
C
B
B
C
C
A
A
题 号
11
12
13
14
15
16
17
18
19
20
答 案
C
A
A
D
C
D
A
C
D
D
二、实验题: (本大题包括2小题,共18分)
21、(1)铁屑溶解,溶液逐渐变为浅绿色,有大量无色气泡产生(2分)
杂质Cu与Fe形成原电池,化学反应速率加快(2分)
(2)2FeC12+2HC1+H2O2=2FeC13+2H2O(2分)
(3)在HCl气氛中加热浓缩,冷却结晶,过滤(2分)
FeC13+3H2O Fe(OH)3 + 3HCl;直接加热时,FeC13水解会产生Fe(OH)3
(2分)
Fe(OH)3 + 3HCl;直接加热时,FeC13水解会产生Fe(OH)3
(2分)
(4)B(2分)
22、(1)A(2分) (2)2H++ 2e-= H2↑ (2分)
(3)2Fe3++ Fe = 3Fe2+ (2分)
三、填空题:(本大题共4小题。共36分)
23、(1)⑤⑥(2分) ①④⑧(2分)
(2)2Fe3++3CaCO3+3H2O = 2Fe(OH)3+3Ca2++3CO2↑ (2分)
或;2Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
Fe(OH)3+3H+ CaCO3+2H+ =
Ca2++H2O+3CO2↑
(3)HCO3-+A1O2-+H2O=Al(OH)3↓+CO32-(2分)
24、(1)B(2分) ;
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2 悬浊液,若Mg(OH)2溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确。(2分)
(3)乙(2分);Mg(OH)2 + 2NH4+ ㄔ Mg2+ + 2NH3?H2O(2分)
25、(1)A、D(2分)
(2)用湿润的红色石蕊试纸放在管口处,若试纸变蓝说明有氨气生成。(2分)
(3)该反应是可逆反应,10mol N2与30mol H2不能完成反应,所以放出的热量小于924kJ。(2分)
(4)N2+6H++6e-=2NH3(2分)
26、(1)0.05(2分), 25 (2分)
(2) H2SO4与(NH4)2SO4(2分), (NH4)2SO4与NH3?H2O(2分)(本小题若其它合理答案也给分)
(3)=7 (2分) (4)BC (2分)
四、计算题:(本大题共6分)27、AgI(2分)、AgCl(2分)、4.1×10-14mol/L(2分)
附加题:
28、(1)BiCl3+H2O=BiOCl↓+2HCl(2分)
(2)不合理 (2分) 因BiOCl中Cl呈-1价而非+1(2分)
(3)将BiCl3溶于含适量HCl的蒸馏水中(2分)
(4)BiOCl+H2O BiOCl+2H++2Cl-,[Cl-]增大时,抑制了BiCl3水解(2分)
BiOCl+2H++2Cl-,[Cl-]增大时,抑制了BiCl3水解(2分)
29、(1) 正反应 (2分) 7.0 (2分)
(2) 不相等(2分) 因为这两种情况是在两个不同温度下达到化学平衡的(2分),平衡状态不同,所以物质的量也不同(2分)。
①B能使湿润的红色石蕊试纸变蓝,D、F不能使湿润的石蕊试纸变色;
②A能使湿润的蓝色石蕊试纸先变红,后褪色;将红热的铜丝放入装有A的瓶中,瓶内充满棕黄色的烟;
③将点燃的镁条放入装有E的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
④D是最简单的有机物;F是空气中含量最多的气体.
⑤实验室中可用浓的C溶液与某黑色固体共热制A气体.
回答下列问题:
(1)B的化学式为
(2)③中发生反应的化学方程式是
| ||
. |
| ||
. |
(3)⑤中发生反应的化学方程式是
| ||
| ||
(4)已知标准状况下体积为1.12L的D完全燃烧生成E和液态水时,放出热量44.5kJ,写出表示1molD燃烧的热化学方程式
(5)一定条件下,向废水中加入CH3OH,将HNO3还原成F.若该反应消耗16gCH3OH转移3mol电子;该反应的化学方程式为
(1)A和D的氢化物中,稳定性较弱的是
(2)元素C在元素周期表中的位置是
(4)写出C、D的最高价氧化物的水化物之间反应的离子方程式
A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) = 2 (a+c) = 3 (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
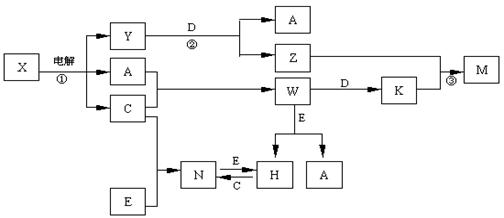
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族。
(2)反应③的离子方程式为 E的氧化物与D在一定条件下反应的化学方程式为: 。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为 。
查看习题详情和答案>>