网址:http://m.1010jiajiao.com/timu_id_253232[举报]
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
B
D
A
B
D
D
11
12
13
14
15
16
17
18
19
20
21
D
B
C
B
B
AC
D
C
A
AC
CD
22 Ⅰ. 2.50(2分) 0.25(2分) 3.50 (3分)
Ⅱ ① 40K(或40×103) (3分)
② A,D,G,H (各1分,共4分)
 ③ 如图所示
③ 如图所示
23. (16分)
解:(1)m在滑动摩擦力的作用下向右加速时加速度达到最大am。
对m由牛顿第二定律得: f=mam ①. ………………..(1分)
f=μN ②.………………..(1分)
N=mg ③……………………(1分)
对M由牛顿第二定律得:F-f=MaM ④…………………(1分)
要使木板能抽出来则要求M的加速度aM大于am。即: aM>am …………...(1分)
解以上方程得: F>4N ……………………(1分)
(2)设F作用时间t1后,m在M上继续相对滑行t2后到M的最左端。
m所经过的位移Sm为:Sm= am(t1+t2)2/2 ⑤………………..(1分)
速度vm为:vm= am(t1+t2) ⑥..………………(1分)
F撤消后,M的加速度 aM2为 f=MaM2 ⑦..………………(1分)
M所经过的位移SM为:SM= aMt12/2 +aMt1t2- aM2t22/2 ⑧………………..(2分)
速度vM为:vM= aMt1- aM2t2 ⑨………………..(1分)
位移关系为: SM- Sm=L ……………….. ..(1分)
此时要求: vM≥ vm ……………….. ..(1分)
 解①----⑨方程组及速度位移关系得: t1≥0.8s
……………….. ..(2分)
解①----⑨方程组及速度位移关系得: t1≥0.8s
……………….. ..(2分)
即力F的作用时间不得少于0.8 s
24 (18分)
解:(1)经加速电场加速:qU0=mv02/2 得v0=8×106m/s …………….. ..(2分)
垂直极板方向做匀加速直线运动,设加速度a,经1×10-8s的时间,侧向位移y
a=qu/md y=at2/2 得y=8×10-3m …………….. ..(3分)
电子进入极板后在平行极板方向做匀速直线运动,垂直极板方向沿同一方向先匀加速再匀减速,再匀加速.匀减速……
经过各n次匀加速.匀减速,则有 2y.n≤d/2
解得 n≤3.125 取n=3 …………….. ..(3分)
则经过加速.减速各3次后距板的距离为△y =d/2-2y×3=2×10-3m
对应的电势差△u=△yU/d=1.82V …………….. ..(2分)
∴电子离开电场时的动能 Ek=q(U0+△u)=183.8eV …………….. ..(3分)
(2)∵△y=y/4
电子在极板中运动的总时间为 ……………..
..(3分)
……………..
..(3分)
∴极板长 L= v0t1=0.52m …………….. ..(2分)
25 (20分)
解:(1)从开始到M第一次着地,设着地速度为v1的过程中,对系统:
由机械能守恒定律:MgH-mgH=(M+m)v12/2 ①……..(2分)
由动量定理得: Mgt-mgt=(m+M)v1 ②……..(2分)
解得: t=1s …………(1分)
(2)设第3次着地时的速度为v3,此时系统损失的机械能△E1即为M的动能
△E1=Mv32/2 ③……….(1分)
m上升后落回速度仍为v3,绳绷直后达到共同速度v3′,损失能量△E2
 绳绷直瞬间系统动量守恒,m的速度在M侧等效向上,与M同向:
绳绷直瞬间系统动量守恒,m的速度在M侧等效向上,与M同向:
m v3=(m+M) v3′ ④……….(2分)
△E2=mv32/2-(m+M) v3′2/2 ⑤………..(2分)
∴ △E1:△E2=4:1 ………….(1分)
(3)设M第一次着地后被m带着上升的高度为H1,
m v1=(m+M) v1′ ⑥……….(1分)
MgH1-mgH1=(M+m)v1′2/2 ⑦……….(2分)
解方程①⑥⑦可得  ……….(2分)
……….(2分)
依此类推可得
 ……….(2分)
……….(2分)
M所走的全部路程为 l=H+2H1+2H1+…2Hn=2.83m ……….(2分)
6
7
8
9
10
11
12
13
D
A
B
D
D
D
B
C
26.(1)4mol/L 溶液的密度 (4分)
(2)b (2分)
(3)2NaOH+2ClO2+H2O2====2NaClO2+2H2O+O2;防止H2O2分解 (3分)
(4)连续测定吸收塔内溶液的PH (2分)
(5) (2分)
(2分)
(6)b.e.d,重结晶 (4分)
27.(1)HCl;H2S;CH4 (每空1分,共3分)
(2)CH4(g)+2O2(g) ====CO2(g)+2H2O(l);△H=-890KJ.mol-1 (3分)
(3)2PH3+4O2====P2O5+3H2O (3分)
 ====
==== (2分)
(2分) ====
==== (2分)
(2分) (3分)
(3分) ====
==== (2分)
(2分) ?L-1
(3分)
?L-1
(3分) 的物质的量为
的物质的量为 ,若分解得到的固体产物全部为
,若分解得到的固体产物全部为 ,则m(残渣)=
,则m(残渣)= ,若
,若
 分解生成的残渣为
分解生成的残渣为 ,则m(残渣)=
,则m(残渣)=

 ,
,
 ③调节和控制饮食,口服降血糖药物,提高受体对胰岛素的敏感度(4分,其他合理答案也可)
③调节和控制饮食,口服降血糖药物,提高受体对胰岛素的敏感度(4分,其他合理答案也可) Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.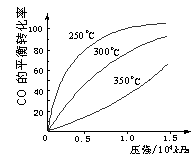 (2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生 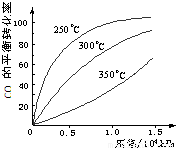
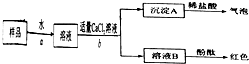 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: