网址:http://m.1010jiajiao.com/timu_id_234847[举报]
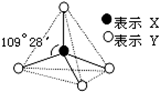 甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、戊三种粒子均含有等量的总电子数,其中丙、戊是同一类晶体中的分子,戊在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体).
(1)写出液态戊产生两种等电子粒子的电离方程式:
(2)写出甲与乙发生置换反应的反应方程式:
| ||
| ||
(3)丙是目前重要的能源之一.
①丙和戊在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是:
| 催化剂 |
| △ |
| 催化剂 |
| △ |
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其负极反应的电极方程式为
(4)含丁的硝酸盐溶液显酸性,原因是(用离子方程式表示):
物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。

查看习题详情和答案>>
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。

(12分)水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
(2)已知2H2O  H3O+
+ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+
+ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
① 在冰晶体中每一个水分子内含有两个氢键;
② 水分子是由极性键构成的极性分子;
③ 水在化学反应中可以作氧化剂,也可以作还原剂;
④ 水分子中既含σ键,又含有π键;
⑤ 纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥ 水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性: 沸点:
查看习题详情和答案>>
(12分)水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
(2)已知2H2O H3O++ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
① 在冰晶体中每一个水分子内含有两个氢键;
② 水分子是由极性键构成的极性分子;
③ 水在化学反应中可以作氧化剂,也可以作还原剂;
④ 水分子中既含σ键,又含有π键;
⑤ 纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥ 水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性: 沸点:
查看习题详情和答案>>