题目内容
物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。

(1)第三周期基态原子有2个未成对电子且电负性最大的元素是_____;
(2)金属晶体受到外力作用时易发生形变,而离子晶体容易破裂。试从结构的角度分析其中的主要原因____________;
(3)已知在水中存在平衡2H2O=H3O++OH-。下列分子中,中心原子采取的杂化方式与H3O+中氧原子的杂化方式相同的是_____
a.CH2=CH2中的碳原子 b.NH2-中的氮原子
c.ClO3-中的氯原子 d.NO2-中的氮原子
(4)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中Mg元素的质量分数为________。

(1)S(或硫磺)(1分) (2)金属晶体是由金属阳离子和“自由电子”通过金属键形成的层状紧密堆积结构(1分),当金属受外力作用时,金属晶体中各原子层会发生相对滑动,产生形变,自由电子使得各层之间始终保持着金属键的作用(1分)。离子晶体中由于阴阳离子间存在着静电作用,使阴阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂(1分)
(3)bc(2分) (4)20%(2分)
(3)bc(2分) (4)20%(2分)
试题分析:(1)第三周期基态原子中含有两个未成对电子的元素有Si、S两种元素,同一周期中,元素的电负性随着原子序数的增大而增大,所以Si的电负性小于S元素。
(2)金属晶体的构成微粒是金属阳离子和自由电子,存在的作用力是金属键,金属晶体是由金属阳离子和自由电子通过金属键形成的层状紧密堆积结构。当金属受外力作用时,金属晶体中各原子层会发生相对滑动,产生形变,自由电子使得各层之间始终保持着金属键的作用;离子晶体中存在的微粒是阴阳离子,存在的作用力是离子键,离子晶体中由于阴阳离子间存在着静电作用,使阴阳离子不能发生自由移动,因而受到外力作用时离子键被破坏而使晶体破裂。
(3)H3O+中中心氧原子含有3个σ键和一个孤电子对,所以其价层电子对数是4,则氧原子采取sp3杂化。a.CH2═CH2中的每个碳原子含有3个σ键且不含孤电子对,所以采取sp2杂化,故错误;b.NH2-中的氮原子含有2个σ键和(5+1-2×1)÷2=2个孤电子对,所以氮原子采取sp3杂化,故b正确;c.ClO3-中的氯原子含有3个σ键和(7+1-3×2)÷2=1个孤电子对,所以其价层电子对数是4,则氯原子采取sp3杂化,故c正确;d.NO2-中的氮原子含有2个σ键和(5+1-2×2)÷2=1个孤电子对,所以其价层电子对数是3,所以氮原子采取sp2杂化,故d错误,因此答案选bc。
(4)根据晶胞结构并依据均摊法可知,该晶胞中含有镁原子个数=8×
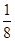 =1,钾原子个数=1,氟原子个数=12×
=1,钾原子个数=1,氟原子个数=12× =3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=
=3,所以其化学式为KMgF3,因此该化合物中镁元素的质量分数=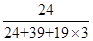 ×100%=20%。
×100%=20%。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 键的个数为 。
键的个数为 。 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用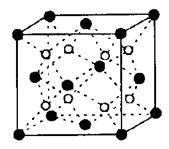
 和O
和O 互为等电子体,所以可以推断O
互为等电子体,所以可以推断O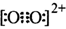
 键。
键。 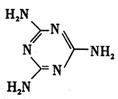


 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
 g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
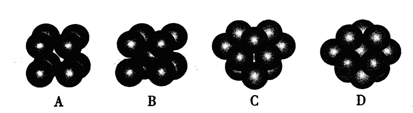
 和
和 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。