题目内容
(12分)水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
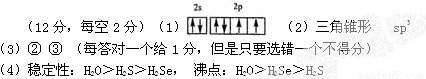
(1)氧原子基态时价层电子的电子排布图为____________。
(2)已知2H2O  H3O+
+ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+
+ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
① 在冰晶体中每一个水分子内含有两个氢键;
② 水分子是由极性键构成的极性分子;
③ 水在化学反应中可以作氧化剂,也可以作还原剂;
④ 水分子中既含σ键,又含有π键;
⑤ 纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥ 水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性: 沸点:
【解析】

水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为: 。
(2)位于第四周期,与氧元素同主族的元素名称是: ;其外围电子排布式是: 。
(3)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是: 。
| A.金刚石 | B.干冰 | C.食盐 | D.固态氨 |
 ?H3O++OH-,H3O+的立体构型是 ,H3O+中含有一种特殊的共价键叫做 。
?H3O++OH-,H3O+的立体构型是 ,H3O+中含有一种特殊的共价键叫做 。(5)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(6)水的分解温度远高于其沸点的原因是:
________________________________________________________________________
 氧原子基态时价层电子的电子排布图为_______ _________。
氧原子基态时价层电子的电子排布图为_______ _________。