摘要:2.第二周期的元素与氢元素所形成的常见分子或离子中.电子总数为10的有 [ ]A.6种以上B.5种C.4种D.3种
网址:http://m.1010jiajiao.com/timu_id_234833[举报]
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为
第二周期第VA族
第二周期第VA族
.根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4
<
<
H3PO4.(用“>”、“<”或“=”表示)(2)元素S的最高正价和最低负价分别为
+6
+6
、-2
-2
,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下,等物质的量的S和Se分别与等量的H2反应,生成气态氢化物的物质的量(b)
(b)
.(a) H2S<H2Se (b) H2S>H2Se (c) H2S=H2Se
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子的形成过程:


(4)试在表上画出金属和非金属的分界线


元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33 | 164 |
查看习题详情和答案>>
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 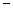 33.35 33.35 | 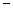 164 164 |
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
 查看习题详情和答案>>
查看习题详情和答案>>