摘要:HS-+H2O H2S+OH-①根据电荷守恒:[Na+]+[H+]=2[S2-]+[HS-]+[OH-].所以B正确.②根据物料守恒:[Na+]=2[S2-]+2[HS-]+2[H2S].所以A错误.根据由水电离产生H+与OH-守恒:[OH-]=[HS-]+[H+]+2[H2S].所以D错误.
网址:http://m.1010jiajiao.com/timu_id_234025[举报]
已知X、Y、Z、W是元素周期表中前20号元素,其中Y和W处于相同周期,且能形成一种常被称为“臭碱”的化合物Y2W.X、Y、Z是金属元素,且原子序数依次增大,若由这3种元素构成的单质的物质的量记为n(X)、n(Y)、n(Z),它们与足量盐酸反应产生H2的体积(标准状况下)记为V(H2)X、V(H2)Y、V(H2)Z,且有下列关系:n(X)=n(Y)=(n)Z,2V(H2)X=V(H2)Y+V(H2)Z.试根据上述信息回答下列问题:
(1)Y2W的电子式为
 ,用离子方程式表示Y2W被称为“臭碱”的原因:
,用离子方程式表示Y2W被称为“臭碱”的原因:
(2)若Z为第3周期元素,则X在元素周期表中的位置是,单质X与单质Z的化学性质相似,试写出单质X与Y的最高价氧化物对应的水化物反应的化学方程式:
(3)若Z为第4周期元素,用化学方程式表示工业上制备单质Y的方法:
查看习题详情和答案>>
(1)Y2W的电子式为


S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
.(2)若Z为第3周期元素,则X在元素周期表中的位置是,单质X与单质Z的化学性质相似,试写出单质X与Y的最高价氧化物对应的水化物反应的化学方程式:
Be+2NaOH=NaBeO2+H2↑
Be+2NaOH=NaBeO2+H2↑
.(3)若Z为第4周期元素,用化学方程式表示工业上制备单质Y的方法:
2NaCl(熔融)
2Na+Cl2↑
| ||
2NaCl(熔融)
2Na+Cl2↑
.已知Y的氢化物能与水剧烈反应生成一种气体单质,当有33.6L(标准状况下)气体生成时,反应中转移的电子数为
| ||
1.5NA
1.5NA
.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水.向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是
(2)W与Y可形成化合物W2Y,该化合物的水溶液显碱性,原因(用离子方程式表示)
(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物.现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出c(OH-)
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
查看习题详情和答案>>
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水.向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是
先生成白色沉淀,并逐渐增加到最大量,然后逐渐减少,直至消失
先生成白色沉淀,并逐渐增加到最大量,然后逐渐减少,直至消失
,反应结束时,该反应的总反应离子方程式为AlO2-+4H+=Al3++2H2O
AlO2-+4H+=Al3++2H2O
.(2)W与Y可形成化合物W2Y,该化合物的水溶液显碱性,原因(用离子方程式表示)
S2-+H2O?HS-+H2O;HS-+H2O?H2S+OH-
S2-+H2O?HS-+H2O;HS-+H2O?H2S+OH-
;它的水溶液中存在多种离子,请写出电荷守恒的等式c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
.(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物.现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出c(OH-)
<
<
②中由水电离出的c(OH-).(填“>”、“=”或“<”)(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
SO2+Cl2+2H2O=2HCl+H2SO4
SO2+Cl2+2H2O=2HCl+H2SO4
.工业上制备BaCl2的工艺流程图如下:
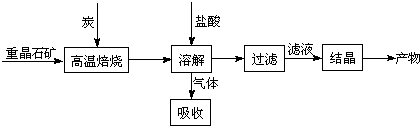
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=226.2kJ?mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
(2)反应C(s)+CO2(g)
2CO(g)的△H2=
(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
①下列措施中,有利于降低大气中CO2浓度的有:
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
C6H12O6 b.CO2+3H2
CH3OH+H2O
c.CO2+CH4
CH3COOH d.2CO2+6H2
CH2═CH2+4H2O
以上反应中,最节能的是
查看习题详情和答案>>

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
| 高温 |
BaSO4(s)+2C(s)
| 高温 |
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
. (2)反应C(s)+CO2(g)
| 高温 |
172.5
172.5
kJ?mol-1.(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
①下列措施中,有利于降低大气中CO2浓度的有:
abcd
abcd
.(填字母)a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
| 光合作用 |
| 催化剂 |
| △ |
c.CO2+CH4
| ||
| △ |
| ||
| △ |
以上反应中,最节能的是
a
a
,原子利用率最高的是c
c
.