题目内容
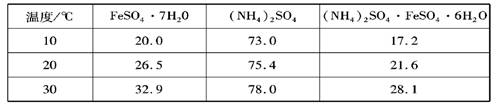
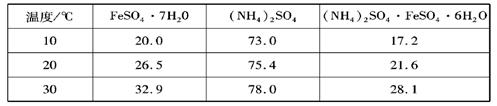
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/l00gH2O)见下表:| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
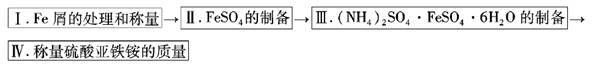
实验步骤流程图:
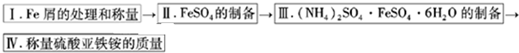
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算)
分析:(1)Na2CO3溶液中CO32-水解CO32-+H2O HCO3-+OH-,使Na2CO3溶液呈碱性.铁屑表面有油污,用显碱性的Na2CO3溶液洗去;
HCO3-+OH-,使Na2CO3溶液呈碱性.铁屑表面有油污,用显碱性的Na2CO3溶液洗去;
(3)由题目可知参加反应的铁的质量为(m1-m2)g,物质的量为
mol,根据铁元素守恒可知,生成FeSO4的物质的量为
mol,由晶体(NH4)2SO4?FeSO4?6H2O可知,需要(NH4)2SO4的物质的量为
mol,进而计算质量,20℃(NH4)2SO4的溶解度为75.4g,根据溶解度计算配成饱和溶液需水的质量.由信息可知硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗.用无水乙醇洗涤硫酸亚铁铵晶体;
(4)根据滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,求出的Fe2+物质的量,(NH4)2SO4?FeSO4?6H2O与Fe2+物质的量相等,因此可以求出(NH4)2SO4?FeSO4?6H2O的质量,最后带入质量分数计算公式.
 HCO3-+OH-,使Na2CO3溶液呈碱性.铁屑表面有油污,用显碱性的Na2CO3溶液洗去;
HCO3-+OH-,使Na2CO3溶液呈碱性.铁屑表面有油污,用显碱性的Na2CO3溶液洗去;(3)由题目可知参加反应的铁的质量为(m1-m2)g,物质的量为
| m1-m2 |
| 56 |
| m1-m2 |
| 56 |
| m1-m2 |
| 56 |
(4)根据滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,求出的Fe2+物质的量,(NH4)2SO4?FeSO4?6H2O与Fe2+物质的量相等,因此可以求出(NH4)2SO4?FeSO4?6H2O的质量,最后带入质量分数计算公式.
解答:解:(1)铁屑表面有油污,将铁屑在Na2CO3溶液中加热,Na2CO3溶液水解显碱性,可使铁屑上附着的油污水解而除去,故答案为:洗涤铁屑表面的油污;
(3)生成FeSO4的物质的量为
mol,所以(NH4)2SO4的物质的量为
mol,令配成饱和溶液需水的质量为mg,20℃(NH4)2SO4的溶解度为75.4g,则:
mol×132g/mol:mg=75.4g:100g,解得:m=3.13(m1-m2).得到硫酸亚铁铵的晶体,硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗,过滤后用无水乙醇洗涤晶体,
故答案为:3.13(m1-m2);无水乙醇;
(4)n(MnO4-)=0.0100mol/L×0.02L=0.0002mol,根据滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知移取25.00mL待测溶液中n(Fe2+)=5×0.0002mol=0.001mol,则1.600g产品中含有的亚铁离子的物质的量为:0.001mol×
=0.004mol,(NH4)2SO4?FeSO4?6H2O物质的量与Fe2+物质的量相等也为0.004mol,(NH4)2SO4?FeSO4?6H2O的质量为:0.004mol×392g/mol=1.568g,因此样品中(NH4)2SO4?FeSO4?6H2O的质量分数为:
×100%=98%,
答:样品中的(NH4)2SO4?FeSO4?6H2O的质量分数为98%.
(3)生成FeSO4的物质的量为
| m1-m2 |
| 56 |
| m1-m2 |
| 56 |
| m1-m2 |
| 56 |
故答案为:3.13(m1-m2);无水乙醇;
(4)n(MnO4-)=0.0100mol/L×0.02L=0.0002mol,根据滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知移取25.00mL待测溶液中n(Fe2+)=5×0.0002mol=0.001mol,则1.600g产品中含有的亚铁离子的物质的量为:0.001mol×
| 100 |
| 25 |
| 1.568g |
| 1.600g |
答:样品中的(NH4)2SO4?FeSO4?6H2O的质量分数为98%.
点评:本题以硫酸亚铁晶体制备实验为起点,进一步拓展和提升来制备摩尔盐,考差盐类水解、溶解度、化学计算、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等.注意基础知识的全面掌握.

练习册系列答案
相关题目
 4、( NH4)2SO4、蒸馏水、无水乙醇。
4、( NH4)2SO4、蒸馏水、无水乙醇。