网址:http://m.1010jiajiao.com/timu_id_232125[举报]
一、选择题(每小题4分,共32分)
题号
1
2
3
4
5
6
7
8
答案
A
B
C
D
D
B
C
C
二、选择题(每小题4分,共32分)
题号
9
10
11
12
13
14
15
16
答案
B
BD
AD
B
BD
C
AD
AD
三、(本题包括2小题,共22分)
17.(每小条2分)(1)150mL,气体体积为110mL,量筒的量程越小,产生的误差越小;
(2)酸式滴定管,酸性KMnO4具有强氧化性,能腐蚀碱式滴定管的乳胶管;
(3)B,防止气体冷却时发生倒吸现象;此时读数由于量筒中气体压强小于外界大气压,使读的气体体积偏大,Na2O2纯度偏高;应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平;
(4)溶液刚好出现浅紫红色,并在半分钟内不褪色;
(5)62.4%
 18.
18.
四、(本题包括2小题,共18分)
19.(1)S1>S3>S2>S4(2分)(2)①b ②c (各1分,共2分)
(3)①HClO4(1分)②离子键、(极性)共价键(1分) NaClO(1分)
③SiO2+2C Si+2CO↑(1分)
Si+2CO↑(1分)
20.(1)D为FeSO4(2分),E为H2S (2分)
(2)离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SO42-(2分)
(3)离子方程式2Cu2++2H2O 2Cu+4H++O2↑(2分)
2Cu+4H++O2↑(2分)
(4)称一定量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(2分)
五、(本题包括1小题,共10分)
21.(1)温度升高,促进电离,所以K值增大(2分)
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强(2分)
(3)H3PO4 HPO42―(2分)
(4)K1:K2:K3≈1:10―5:10―10 (2分) 上一级电离产生的H+对下一级电离有抑制作用 (2分)
六、(本题包括2小题,共18分)

 22.(8分)(I)C2nH3nPn
。
22.(8分)(I)C2nH3nPn
。
(II)C20H30O2,
23.(10分)
(1) (3分) (2)略(3分) (3)4(2分)
(4)7(2分)
(3分) (2)略(3分) (3)4(2分)
(4)7(2分)
七、(本题包括2小题,共18分)
24.(6分)(1)44 (2分) (2)A分子中含一个羟基和一个羧基,1molA消耗2molNaOH n(HCl)= 0.02 L×0.100mol/L= 0.002mol (1分) 。苯酚与A的混合物消耗的NaOH物质的量为:0.05L×1.000mol/L―0.002mol× =0.03mol (1分) 依题意可得:
=0.03mol (1分) 依题意可得:
 n(C6H5OH)+2×n(A)=0.03mol
n(C6H5OH)+2×n(A)=0.03mol
94 g/mol×n(C6H5OH)+138g/mol×n(A)=2.32 g
n(C6H5OH)=0.01mol m(C6H5OH)=0.94g
w (C6H5OH)= ×100%=40.5%(或0.405) (2分)
×100%=40.5%(或0.405) (2分)
25.⑴(共4分)NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl
20.00mLB溶液消耗0.1000mol?L-1NaOH 30.00mL。
20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol ,
100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol
故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol(2分)
[Co(NH3)xCly]Clz中氮元素的质量分数
 (2分)
(2分)
⑵(共6分)I2+2Na2S2O3==2NaI+Na2S4O6
因反应用去0.1000mol?L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol(1分)
Co与Fe同一族,Com+具有强氧化性,故设m=3
则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol (1分)
0.5010g样品中Cl的总质量为:
m(Cl)=0.5010g-0.002000molx59g?mol -1-0.01000molx17g ?mol -1=0.2130g
n(Cl)=0.006000mol(1分)
又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
0.2505g样品扩大一倍来算(即用0.5010g)推算出:
反应消耗AgNO3:n(AgNO3)=0.1000mol?L-1x40.00mL=0.004000mol
即发生上述反应的Cl-为:n(Cl-) =0.004000mol(1分)
则有 y:z=(0.006000mol-0.004000 mol): 0.004000mol=1:2
同时还有:1:x:(y+z)= 0.002000: 0.01000: 0.006000=1:5:3
解得:x=5 y=1 z=2
带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立
该钴化合物的化学式为:[Co(NH3)5Cl]Cl2(3分)
答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94%
⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)(1)有500ml、250ml、150ml的量筒备用,应选用量程为
(2)该实验应选用
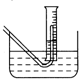
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度
(4)在步骤④中用到的仪器除了容量瓶外还需要
(5)在步骤⑤中反应的离子方程式是
(6)该过氧化钠的纯度为
①称取过氧化钠固体2.00g;
②把这些过氧化钠固体放入气密性良好的气体发生装置中;
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在110mL处恰好与水槽内液面相平;
④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切;
⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为
(2)有酸式和碱式两种滴定管备用,该实验应选用
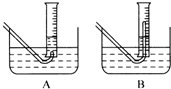
(3)在步骤③测量气体体积时,必须待试管和量筒内的气体都冷却到室温时进行,应选用右图装置中
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是
(5)该过氧化钠的纯度为
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500ml、250ml、150ml的量筒备用,应选用量程为______的量筒
(2)该实验应选用______(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是______
(4)在步骤④中用到的仪器除了容量瓶外还需要______
(5)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是______
(6)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)
查看习题详情和答案>>
(1)有500ml、250ml、150ml的量筒备用,应选用量程为______的量筒
(2)该实验应选用______(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是______
(4)在步骤④中用到的仪器除了容量瓶外还需要______
(5)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是______
(6)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)
Na2O2与水的反应实际是Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑。为了测定某过氧化钠固体的纯度,做如下实验:

①称取过氧化钠固体2.00g;
②把这些过氧化钠固体放入气密性良好的气体发生装置中;
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;
④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切
⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.0100mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLMnO4溶液(此时猛全部以Mn2+存在)
(1)有酸式和碱式两种滴定管备用,该实验应选用 ,理由是 。
(2)在步骤③测量气体体积时,必须待试管和量筒内的气体都冷却到室温时进行,应选用上图装置中 。为使量筒为液面恰好与水槽内液面相平,应进行的操作是 。
(3)用酸性KMnO4溶液滴定所配制的溶液,发生反应的离子方程式是 。
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是 。
(5)该过氧化钠的纯度为 (实验中得到气体体积均看作为标准状况下)。
查看习题详情和答案>>