摘要:已知:N2(g)+H2(g) 2NH3(g);△H=-92.4kJ/mol请回答: (1)合成氨对工业中采取的下列措施可以用勒夏特列原理解释的是 . a.用铁触媒加快化学反应速率 b.采用较高压强(20M Pa―50M Pa) c.将原料气中的少量CO等气体净化出来 d.将生成的氨液化并及时从体系中分离出来 (2)一定温度下.在密闭容器中充入1 molN2和3molH2并发生反应. ①若容器容积恒定.达到平衡时.气体的压强为原来的7/8.则N2的转化率α1= ,此时反应放出的热量 kJ; ②若容器压强恒定,则达到平衡时,容器中N2的转化率=α2 α1(填“< “> 或“= )
网址:http://m.1010jiajiao.com/timu_id_204563[举报]
1―5ADCCA 6―10DABBC 11―15BCABB 16―20BCDBD
第II卷(共50分)
21.NH3 NO HCl O2 H2
22.(1)略 三角锥
(2)略 H2O2+SO2=H2SO4 4OH-―4e=2H2O+O2
(3)根据液面上升的速率不同区分,氨气的溶解度大于二氧化硫,液面上升的速率
(4)C(OH-) C(SO42-) C(NH4+) C(OH-)
23.(1) bd
(2)①25% 23.1 ②>
(3)阴 N2+6e-+6H-=2NH3
24.(1)Al2O3 H2


 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答: H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。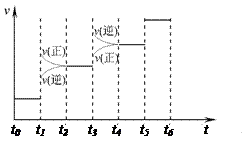
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:
2NH3(g) ΔH=-92.4kJ·mol-1。请回答: H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。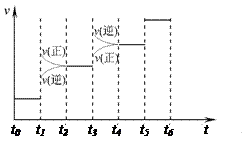
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: