摘要:23.合成氨对工.农业生产和国防都有重要意义.
网址:http://m.1010jiajiao.com/timu_id_204562[举报]
1―5ADCCA 6―10DABBC 11―15BCABB 16―20BCDBD
第II卷(共50分)
21.NH3 NO HCl O2 H2
22.(1)略 三角锥
(2)略 H2O2+SO2=H2SO4 4OH-―4e=2H2O+O2
(3)根据液面上升的速率不同区分,氨气的溶解度大于二氧化硫,液面上升的速率
(4)C(OH-) C(SO42-) C(NH4+) C(OH-)
23.(1) bd
(2)①25% 23.1 ②>
(3)阴 N2+6e-+6H-=2NH3
24.(1)Al2O3 H2

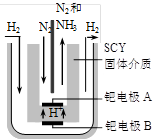
 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答: ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);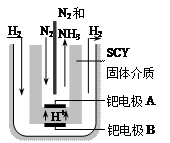
 2NH3(g);△H=
-92.4 kJ·mol-1,请回答:
2NH3(g);△H=
-92.4 kJ·mol-1,请回答: ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答: