题目内容
合成氨对工、农业生产和国防都有重要意义。已知:25℃时,N2(g)+3H2(g)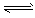 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:
(1)已知:破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。计算1mol
N2 (g) 和3 mol H2 (g) 完全转化为NH3(g)的反应热的理论值___________ 。
(2)对合成氨平衡体系改变以下条件,判断平衡移动方向:
I ①恒容容器中充入氦气,平衡________移动(填“正向”、“逆向”、“不移动”,下同);
②恒容容器中充入氮气,平衡________移动;
③恒容容器中充入氨气,平衡________移动;
II 恒压容器内充入氦气,平衡________移动。
(3)在密闭容器中,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________ 。
a 平衡不发生移动
b 平衡向正反应方向移动
c 平衡向逆反应方向移动
d.NH3的质量分数增加
e 正、逆反应速率都增大
(4)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
① 20 MPa -5 0 MPa
②500℃的高温
③铁触媒作催化剂
④ 将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
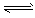 2NH3(g);△H<0,请回答:
2NH3(g);△H<0,请回答:(1)已知:破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ。计算1mol
N2 (g) 和3 mol H2 (g) 完全转化为NH3(g)的反应热的理论值___________ 。
(2)对合成氨平衡体系改变以下条件,判断平衡移动方向:
I ①恒容容器中充入氦气,平衡________移动(填“正向”、“逆向”、“不移动”,下同);
②恒容容器中充入氮气,平衡________移动;
③恒容容器中充入氨气,平衡________移动;
II 恒压容器内充入氦气,平衡________移动。
(3)在密闭容器中,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是_________ 。
a 平衡不发生移动
b 平衡向正反应方向移动
c 平衡向逆反应方向移动
d.NH3的质量分数增加
e 正、逆反应速率都增大
(4)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
① 20 MPa -5 0 MPa
②500℃的高温
③铁触媒作催化剂
④ 将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
(1)-92 kJ·mol-1或92 kJ
(2)I 不移动;正向;逆向; II 逆向
(3)bde
(4)②③
(2)I 不移动;正向;逆向; II 逆向
(3)bde
(4)②③

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
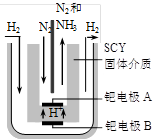
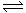 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答: ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);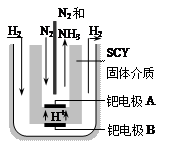
 2NH3(g);△H=
-92.4 kJ·mol-1,请回答:
2NH3(g);△H=
-92.4 kJ·mol-1,请回答: ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);