摘要:(2)2Al+ 2OH-+2H2O=2 AlO2-+3H2↑, 3Fe+4H2OFe3O4+3H2(3)Fe3O4+8HCl=FeCl2+FeCl3+4H20, 2 Fe3++Fe=3 Fe2+
网址:http://m.1010jiajiao.com/timu_id_204529[举报]
工业上以铝土矿(主要成分是A12O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下:
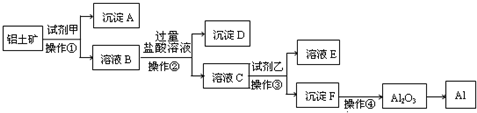
请回答:
(1)工业上Al2O3 冶炼Al所采用的方法是
(2)加入试剂甲后发生反应的离子方程式有两个,一是
(3)在溶液B中加入过量盐酸溶液的目的是
(4)加入试剂乙后发生反应的离子方程式
(5)铝与氢氧化钠溶液反应的离子方程式为
查看习题详情和答案>>

请回答:
(1)工业上Al2O3 冶炼Al所采用的方法是
电解熔融的Al2O3
电解熔融的Al2O3
,化学方程式2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
(2)加入试剂甲后发生反应的离子方程式有两个,一是
SiO2+2OH-═SiO32-+H2O
SiO2+2OH-═SiO32-+H2O
,二是Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.(3)在溶液B中加入过量盐酸溶液的目的是
除去硅酸根离子,将偏铝酸根离子转化为铝离子
除去硅酸根离子,将偏铝酸根离子转化为铝离子
.(4)加入试剂乙后发生反应的离子方程式
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
.(5)铝与氢氧化钠溶液反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(2010?伊春模拟)如图表示各物质之间的转化关系.已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液.请按要求填空:

(1)写出B的电子式:
(2)生成E的电极为
(3)反应①的化学方程式是
(4)反应⑥的离子方程式是
查看习题详情和答案>>

(1)写出B的电子式:
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
. ]2-Na+
]2-Na+(2)生成E的电极为
阳极
阳极
(“阴极”或“阳极”)写出该电极的电极反应式:Fe+2OH--2e-=Fe(OH)2
Fe+2OH--2e-=Fe(OH)2
,反应⑤的现象是白色物质迅速转变为灰绿色最终变为红褐色
白色物质迅速转变为灰绿色最终变为红褐色
.(3)反应①的化学方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
.
| ||
(4)反应⑥的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.向一铝制易拉罐中充满CO2后,再往罐中注入足量的质量分数为20%的NaOH溶液立即严封罐口,不一会儿就发现易拉罐变瘪,再过一会易拉罐又鼓胀起来,解释上述实验现象.
(1)易拉罐开始变瘪的原因是:
(2)易拉罐又鼓胀起来的原因是:
查看习题详情和答案>>
(1)易拉罐开始变瘪的原因是:
CO2被吸收,使罐内气体压强减小而被外界大气压压瘪
CO2被吸收,使罐内气体压强减小而被外界大气压压瘪
;反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
.(2)易拉罐又鼓胀起来的原因是:
由于铝与NaOH反应生成H2,气体压强又增大而重新鼓起
由于铝与NaOH反应生成H2,气体压强又增大而重新鼓起
;其反应的离子方程式为:2Al+2OH-+2H2O═2AlO+3H2↑
2Al+2OH-+2H2O═2AlO+3H2↑
.立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径.
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮.观察钠的颜色.这个实验中还需用到的一种仪器是
(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯.把反应的现象和相应结论填入空格.“浮”---钠的密度比水小;
“熔”---
“红”---反应生成了氢氧化钠;
(3)实验3:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象.试写出铝和NaOH溶液反应的离子方程式:
(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体.向反应后的溶液中加入酚酞试液,可以看到
(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气.该氧化还原反应的氧化剂是
(6)实验6:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色.发生这种颜色变化的原因是(用化学方程式表示):
查看习题详情和答案>>
(1)实验1:取一块金属钠,在玻璃片上用滤纸吸干表面的煤油后,用小刀切去一端的外皮.观察钠的颜色.这个实验中还需用到的一种仪器是
镊子
镊子
;(2)实验2:向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把一小块钠投入小烧杯.把反应的现象和相应结论填入空格.“浮”---钠的密度比水小;
“熔”---
钠的熔点低,反应放热
钠的熔点低,反应放热
;“红”---反应生成了氢氧化钠;
(3)实验3:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象.试写出铝和NaOH溶液反应的离子方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;(4)实验4:把水滴入盛有Na2O2固体的试管中,立即用带火星的木条放在试管口,检验生成的气体.向反应后的溶液中加入酚酞试液,可以看到
溶液先变红后褪色
溶液先变红后褪色
;(5)实验5:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气.该氧化还原反应的氧化剂是
水蒸气
水蒸气
;(6)实验6:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色.发生这种颜色变化的原因是(用化学方程式表示):
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
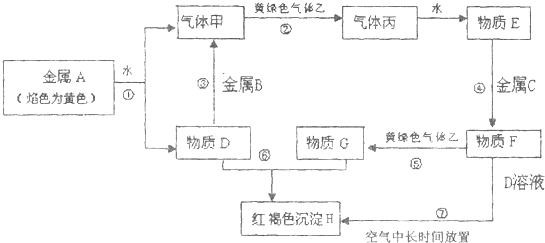
请根据以上信息回答下列问题:
(1)金属A、B、C分别是
(2)反应③的离子方程式为
(3)反应过程⑦涉及到的化学方程式
(4)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成.该反应的化学方程式为
查看习题详情和答案>>

请根据以上信息回答下列问题:
(1)金属A、B、C分别是
Na
Na
、Al
Al
、Fe
Fe
.(2)反应③的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3 H2↑
2Al+2OH-+2H2O=2AlO2-+3 H2↑
,在标准状况下测得,生成气体甲112mL,转移的电子数为0.01mol
0.01mol
.(3)反应过程⑦涉及到的化学方程式
FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(4)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成.该反应的化学方程式为
Cl2+2Na2CO3+H2O=2NaHCO3+NaClO+NaCl
Cl2+2Na2CO3+H2O=2NaHCO3+NaClO+NaCl
.