网址:http://m.1010jiajiao.com/timu_id_199255[举报]
选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
D
D
D
C
A
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
A
C
B
A
D
B
C
B
D
21.(1)24FeSO4+30HNO3→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)FeSO4 +5价N (3) 得到 4
22.(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-  H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
 (2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
23.(1) 0.01mol/L. min
(2) a=0.05 mol/L 图象如右
(3) BD
24.(1)Br2 ;Fe3+
(2)
乙 同学正确
选用试剂
实验现象
第一种方法
C
有机层无色
第二种方法
D
溶液变红
(3)Fe2+;不可以,因为Br2和Fe3+都能把I―氧化成I2
25.(1)b;
(2)将亚铁离子氧化为铁离子;
(3)除去过量的硫酸;不引入新的杂质;
(4)Fe3++3H2O=Fe(OH)3↓+3H+;(条件:加热)
(5)抑制Cu2+的水解;产生污染环境的二氧化硫,硫酸利用率低;加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)
 26.
26. ⑴ C6H5-CH-18OH CH3CH2- -18OH
⑴ C6H5-CH-18OH CH3CH2- -18OH

 ⑵C6H5-CH-18OH+HCOOH
⑵C6H5-CH-18OH+HCOOH HCO18O-CH-C6H5+H2O
HCO18O-CH-C6H5+H2O
⑶

计算题
27.(1)0.8mol/L (2)29.6%
附加题
1.B
2.C
3.(1)除去混在氢气中的酸性气体
(2)A B、C; 将E中的产生的硫酸亚铁溶液压入D中
(3)②
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案
|
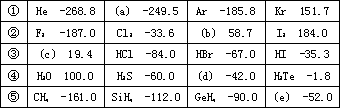
有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的是 | |
A. |
上表中各物质形成的晶体均为分子晶体 |
B. |
系列②物质均有氧化性;系列③物质对应水溶液均是强酸 |
C. |
系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te |
D. |
上表内物质HF和H2O,由于氢键的影响,其分子特别稳定 |
|
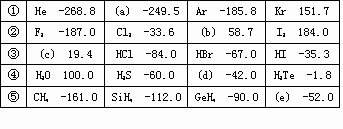
有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的是 | |
A. |
a、b、c的化学式分别为Ne、Br2、HF |
B. |
系列②物质均有氧化性;系列③物质对应水溶液均是强酸 |
C. |
系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te |
D. |
上表内物质HF和H2O,由于氢键的影响,其分子特别稳定 |
|
有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的是 | |
A. |
a、b、c的化学式分别为Ne、Br2、HF |
B. |
系列②物质均有氧化性;系列③物质对应水溶液均是强酸 |
C. |
系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te |
D. |
上表内物质HF和H2O,由于氢键的影响,其分子特别稳定 |
试回答:
(1)化合物ABC中σ键和π键个数比为


(2)A、D、E 三种元素可形成一种离子化合物R,用惰性电极电解 R 的稀溶液,电解一段时间后,溶液 pH
(3)在0.1mol?L-1E2BD3的溶液中,各离子浓度由大到小的顺序是
(4)某密闭容器中发生如下反应:C2(g)+3A2(g)?2CA3(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
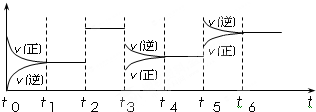
A.t5时增大了压强 B.t3时降低了温度
C.t2时加入了催化剂 D.t4~t5时间内转化率一定最低
(5)单质A的燃烧热为akJ/mol,12gB单质燃烧生成化合物BD放出热量bkJ,1mol化合物A2D由液态变为气态需吸收热量ckJ,写出单质B制水煤气的热化学方程式
试回答:
(1)化合物ABC中σ键和π键个数比为______,它属于______分子(填“极性”或“非极性”).化合物C2A2是一种高能量分子,且C 原子满足8 电子稳定结构.写出C2A2的电子式______.
(2)A、D、E 三种元素可形成一种离子化合物R,用惰性电极电解 R 的稀溶液,电解一段时间后,溶液 pH______(填“增大”、“减小”或“不变”).
(3)在0.1mol?L-1E2BD3的溶液中,各离子浓度由大到小的顺序是______;分子式为 A2B2D4的化合物,与等物质的量的 KOH 溶液反应后溶液呈酸性,其原因是(用文字填空)______.
(4)某密闭容器中发生如下反应:C2(g)+3A2(g)?2CA3(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______

A.t5时增大了压强 B.t3时降低了温度
C.t2时加入了催化剂 D.t4~t5时间内转化率一定最低
(5)单质A的燃烧热为akJ/mol,12gB单质燃烧生成化合物BD放出热量bkJ,1mol化合物A2D由液态变为气态需吸收热量ckJ,写出单质B制水煤气的热化学方程式______.
查看习题详情和答案>>