题目内容
A、B、C、D、E为原子序数依次增大的五种短周期元素.A、E同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D最外层电子数之和与E的核外电子总数相等.试回答:
(1)化合物ABC中σ键和π键个数比为______,它属于______分子(填“极性”或“非极性”).化合物C2A2是一种高能量分子,且C 原子满足8 电子稳定结构.写出C2A2的电子式______.
(2)A、D、E 三种元素可形成一种离子化合物R,用惰性电极电解 R 的稀溶液,电解一段时间后,溶液 pH______(填“增大”、“减小”或“不变”).
(3)在0.1mol?L-1E2BD3的溶液中,各离子浓度由大到小的顺序是______;分子式为 A2B2D4的化合物,与等物质的量的 KOH 溶液反应后溶液呈酸性,其原因是(用文字填空)______.
(4)某密闭容器中发生如下反应:C2(g)+3A2(g)?2CA3(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______

A.t5时增大了压强 B.t3时降低了温度
C.t2时加入了催化剂 D.t4~t5时间内转化率一定最低
(5)单质A的燃烧热为akJ/mol,12gB单质燃烧生成化合物BD放出热量bkJ,1mol化合物A2D由液态变为气态需吸收热量ckJ,写出单质B制水煤气的热化学方程式______.
【答案】分析:A能与B、C、D分别形成电子数相等的三种分子,B、C、D为多为氢化物,常含10个电子或18个电子,则A应为H元素,A、E同主族,且E的原子序数最大,应为Na元素,C、D最外层电子数之和与E的核外电子总数相等,总共为11,则C为N元素,D为O元素,由原子序数依次增大,且B能形成氢化物可知B为C元素,结合元素对应的单质,化合物的性质解答该题.
解答:解:A能与B、C、D分别形成电子数相等的三种分子,B、C、D为多为氢化物,常含10个电子或18个电子,则A应为H元素,A、E同主族,且E的原子序数最大,应为Na元素,C、D最外层电子数之和与E的核外电子总数相等,总共为11,则C为N元素,D为O元素,由原子序数依次增大,且B能形成氢化物可知B为C元素,
(1)化合物ABC为HCN,结构式为HC≡N,含有2个σ键和2个π键,二者比值为1:1,为极性分子,化合物C2A2为N2H2,
N原子满足8电子稳定结构,电子式应为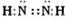 ,故答案为:1:1;极性;
,故答案为:1:1;极性;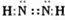 ;
;
(2)A、D、E 三种元素可形成一种离子化合物R为NaOH,电解时溶液浓度增大,pH增大,故答案为:增大;
(3)E2BD3为Na2CO3,为强碱弱酸盐,水解呈碱性,以第一步水解为主,溶液中离子浓度大小顺序为
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),分子式为H2C2O4的化合物,与等物质的量的 KOH 溶液反应生成KHC2O4,溶液中存在HC2O4-的电离和水解,反应后溶液呈酸性,说明HC2O4-的电离程度大于HC2O4-的水解程度,
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);HC2O4-的电离程度大于HC2O4-的水解程度;
(4)由图象可知:
A.t5时逆反应速率大于正反应速率,且反应速率都增大,应为升高温度,如增大了压强,正反应速率应大于逆反应速率,故A错误;
B.t3时正逆反应速率都减小,且逆反应速率大于正反应速率,应是降低压强的原因,故B错误;
C.t2时正逆反应速率都增大,且平衡不移动,应是加入了催化剂,故C正确;
D.t5~t6时间内转化率一定最低,故D错误.
故答案为:C;
(5)已知单质H2的燃烧热为akJ/mol,12gC单质燃烧生成化合物CO放出热量bkJ,1mol化合物H2O由液态变为气态需吸收热量ckJ,
则可得热化学方程式分别为:①H2(g)+ O2(g)=H2O(l)△H=-akJ/mol;
O2(g)=H2O(l)△H=-akJ/mol;
②C(s)+ O2(g)=CO(g)△H=-bkJ/mol;
O2(g)=CO(g)△H=-bkJ/mol;
③H2O(l)=H2O(g)△H=+ckJ/mol,
则利用盖斯定律将②-①-③可得C(s)+H2O(g)=CO(g)+H2(g)△H=(a-b-c)kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=(a-b-c)kJ/mol.
点评:本题考查原子结构与元素周期律知识,题目难度中等,解答本题时注意把握原子核外电子排布关系,学习中注意利用盖斯定律计算反应热的方法.
解答:解:A能与B、C、D分别形成电子数相等的三种分子,B、C、D为多为氢化物,常含10个电子或18个电子,则A应为H元素,A、E同主族,且E的原子序数最大,应为Na元素,C、D最外层电子数之和与E的核外电子总数相等,总共为11,则C为N元素,D为O元素,由原子序数依次增大,且B能形成氢化物可知B为C元素,
(1)化合物ABC为HCN,结构式为HC≡N,含有2个σ键和2个π键,二者比值为1:1,为极性分子,化合物C2A2为N2H2,
N原子满足8电子稳定结构,电子式应为
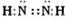 ,故答案为:1:1;极性;
,故答案为:1:1;极性;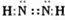 ;
;(2)A、D、E 三种元素可形成一种离子化合物R为NaOH,电解时溶液浓度增大,pH增大,故答案为:增大;
(3)E2BD3为Na2CO3,为强碱弱酸盐,水解呈碱性,以第一步水解为主,溶液中离子浓度大小顺序为
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),分子式为H2C2O4的化合物,与等物质的量的 KOH 溶液反应生成KHC2O4,溶液中存在HC2O4-的电离和水解,反应后溶液呈酸性,说明HC2O4-的电离程度大于HC2O4-的水解程度,
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);HC2O4-的电离程度大于HC2O4-的水解程度;
(4)由图象可知:
A.t5时逆反应速率大于正反应速率,且反应速率都增大,应为升高温度,如增大了压强,正反应速率应大于逆反应速率,故A错误;
B.t3时正逆反应速率都减小,且逆反应速率大于正反应速率,应是降低压强的原因,故B错误;
C.t2时正逆反应速率都增大,且平衡不移动,应是加入了催化剂,故C正确;
D.t5~t6时间内转化率一定最低,故D错误.
故答案为:C;
(5)已知单质H2的燃烧热为akJ/mol,12gC单质燃烧生成化合物CO放出热量bkJ,1mol化合物H2O由液态变为气态需吸收热量ckJ,
则可得热化学方程式分别为:①H2(g)+
 O2(g)=H2O(l)△H=-akJ/mol;
O2(g)=H2O(l)△H=-akJ/mol;②C(s)+
 O2(g)=CO(g)△H=-bkJ/mol;
O2(g)=CO(g)△H=-bkJ/mol;③H2O(l)=H2O(g)△H=+ckJ/mol,
则利用盖斯定律将②-①-③可得C(s)+H2O(g)=CO(g)+H2(g)△H=(a-b-c)kJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=(a-b-c)kJ/mol.
点评:本题考查原子结构与元素周期律知识,题目难度中等,解答本题时注意把握原子核外电子排布关系,学习中注意利用盖斯定律计算反应热的方法.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答: