网址:http://m.1010jiajiao.com/timu_id_18858[举报]
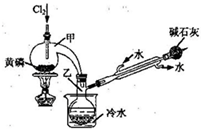 (2011?南京二模)PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(2011?南京二模)PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:| 熔点/℃ | 沸点/℃℃℃ | 密度/g?cm-3 | 其他 | |||||||||
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105 3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
①向甲中通入干燥的Cl2之前,需先通入一段时间CO2,目的是
②实验过程中,应控制
③蒸馏烧瓶乙中得到的粗产品含有POCl3、PCl5
等.加入黄磷加热除去PCl5后,通过
(2)已知:
a.H3PO3+H2O+I2?H3PO4+2HI
b.(NH4)3BO3,溶液可与HI和H3PO4反应生成H3BO3
c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3=Na2S4O6+2NaI
①测定产品中PCl3质量分数的实验如下,请补充相应的实验步骤:
步骤1:迅速移取mg产品,水解完全后在500mL容量瓶中定容;
步骤2:从容量瓶中移取25.00mL溶液置于碘量瓶中;
步骤3:准确加入c1mol?L-1碘溶液V1 mL(过量),再
步骤4:
2.75(c1v1-
| ||
| m |
2.75(c1v1-
| ||
| m |
(1)实验室是用二氧化锰和浓盐酸反应制氯气,其化学方程式是:MnO2+4HCl(浓)
| ||
写出该反应的离子方程式
(2)把红热的铁丝插入已收集满氯气的集气瓶中.
可观察的现象:
(3)如果把干燥的氯气通入干燥的有色布条中,布条
(4)多余的氯气要用氢氧化钠溶液吸收,写出该反应的离子方程式:
(5)Cl2有
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量为m1.
②往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到质量m2.
③往锥形瓶内加满水,塞好胶塞,称量得到质量m3.
已知实验时的温度T(K),压强p(kPa),水的密度ρ水(g?mL-1),空气的平均相对分子质量为29.0,密度ρ空气(g?L-1).回答下列问题:
(1)本实验的原理是(具体说明)
(2)步骤②中为什么要重复操作,直到前后两次称量结果基本相同?答
(3)具体说明本实验中怎样做到每次测量都是在相同体积下进行的.
(4)由实验测得该烷烃的平均相对分子质量是
| m样品 |
| m空气 |
| m2-m1 |
| m3-m1 |
| ρ水 |
| ρ空气 |
| m样品 |
| m空气 |
| m2-m1 |
| m3-m1 |
| ρ水 |
| ρ空气 |
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
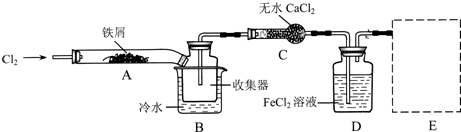
①检验装置的气密性:
②通入干燥的Cl2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为
| ||
| ||
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中冷水浴的作用为
(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
|
|
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
|
黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 |
|
PCl3 |
-112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
|
POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
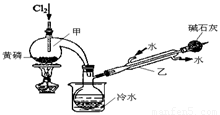
(1)向甲中通入干燥的Cl2之前,需先通入一段时间CO2,目的是 。
(2)实验过程中,应控制 ,以减少PCl5的生成。
(3)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(4)已知:a.H3PO3+H2O+I2
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
①测定产品中PCl3质量分数的实验如下,请补充相应的实验步骤:
步骤1:迅速移取m g产品,水解完全后在500mL容量瓶中定容。
步骤2:从容量瓶中移取25.00mL溶液置于锥形瓶中。
步骤3:准确加入c1 mol/L碘溶液V1 mL(过量),再 。
步骤4:用标准Na2S2O3溶液回滴过量的碘,将近终点时加入3 mL淀粉溶液,继续滴至终点(蓝色溶液褪色);滴至终点时消耗c2 mol/L Na2S2O3溶液V2 mL。
②根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示)。
查看习题详情和答案>>
 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量)