题目内容
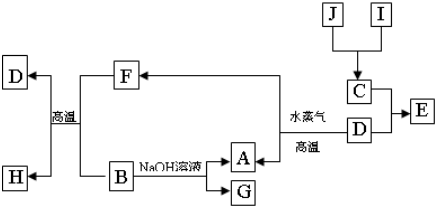
(15分)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,其中D为黄绿色。甲、乙、丙为常见的化合物。它们之间的转化关系如下图所示:
回答下列问题:
(1)化合物乙的名称__________。
(2)B与甲反应的化学方程式是____________________。
(3)由丙的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是__________;若要提纯该胶体,采用的操作方法叫_____。如果用该胶体做电泳实验,___极附近颜色加深。
(4)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,混合物中B的物质的量为_____mol(用含字母的代数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积的标准状况下为mL,该反应中转移电子的物质的量为_____mol,原混合物中A的质量为__________g(用含字母的代数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌后,过滤,沉淀经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中B的质量分数为_____。
(15分)
(1)偏铝酸钠 ( 2分)
(2)8Al+3Fe3O4  9Fe+4Al2O3 (2分)
9Fe+4Al2O3 (2分)
(3)1 nm~100 nm (1分); 渗析(1分); 阴(1分)
(4)①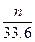 (2分);②
(2分);② (2分)
(2分) ;
; (2分);③ 30%(2分)
(2分);③ 30%(2分)
解析

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为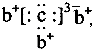 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为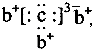 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
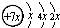 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 Al(OH)3+OH-
Al(OH)3+OH-