摘要:① 该条件下N2的平衡转化率,②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数.五.
网址:http://m.1010jiajiao.com/timu_id_181567[举报]
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁 四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
(1)下列说法一定正确的是
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t2时改变的条件是
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
则各平衡常数间的大小关系为
查看习题详情和答案>>
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
acdh
acdh
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
减小
减小
(填“增大”或“减小”),O2的浓度减小
减小
(填“增大”或“减小”)②假设又向容器中加入一定量的SO3(g),X(SO2)
减小
减小
(填“增大”或“减小”)(3)平衡时,乙容器中SO2的体积分数为
46
46
%(保留两位有效数字),该反应的平衡常数为1.5L?mol-1
1.5L?mol-1
(填具体值和单位,保留两位有效数字)(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t2时改变的条件是
升高温度
升高温度
;②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
K1>K2=K3=K4
K1>K2=K3=K4
(由大到小排列)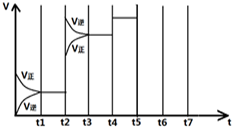 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
a、Q2<Q1<197kJ b、X2<X1<100% c、Q1=78.8 d、X1=2X2
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t2时改变的条件是
②若t 5时降低压强,试画出v-t图象③若各阶段对应的平衡常数如图所示
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁 四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
(1)下列说法一定正确的是______
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)______(填“增大”或“减小”),O2的浓度______(填“增大”或“减小”)
②假设又向容器中加入一定量的SO3(g),X(SO2)______ (填“增大”或“减小”)
(3)平衡时,乙容器中SO2的体积分数为______%(保留两位有效数字),该反应的平衡常数为______(填具体值和单位,保留两位有效数字)
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t 2时改变的条件是______;
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
则各平衡常数间的大小关系为______(由大到小排列)
查看习题详情和答案>>
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | Q1 | X1 | ||
| 乙 | 1 | 0.5 | Q2=39.4 | X2 | ||
| 丙 | 1 | 0.5 | 1 | Q3 | X3 | |
| 丁 | 1.8 | 0.9 | 0.2 | Q4 | X4 | |
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)______(填“增大”或“减小”),O2的浓度______(填“增大”或“减小”)
②假设又向容器中加入一定量的SO3(g),X(SO2)______ (填“增大”或“减小”)
(3)平衡时,乙容器中SO2的体积分数为______%(保留两位有效数字),该反应的平衡常数为______(填具体值和单位,保留两位有效数字)
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t 2时改变的条件是______;
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看习题详情和答案>>
| |||||||||||||||||||
对工业合成氨条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I.N2(g)+3H2(g)?2NH3(g)△H=-90.0kJ/mol.II.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 .
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如下图(图中所示数据均为初始物理量).
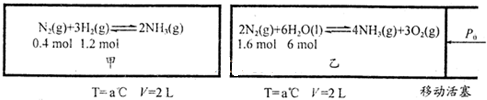
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解).
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转换率= .
(3)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如下图.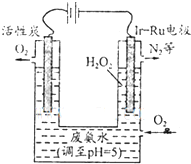
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+) c(NO3-)(填“>”、“<”或“=”);
②Ir-Ru惰性电极有吸附O2作用,该电极的反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3?H2O的物质的量为 .
查看习题详情和答案>>
I.N2(g)+3H2(g)?2NH3(g)△H=-90.0kJ/mol.II.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
(1)根据上述反应,写出表示H2燃烧热的热化学方程式
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如下图(图中所示数据均为初始物理量).

反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解).
①该条件下甲容器中的K=
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转换率=
(3)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如下图.

①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
②Ir-Ru惰性电极有吸附O2作用,该电极的反应为
③理论上电路中每转移3mol电子,最多可以处理NH3?H2O的物质的量为
