题目内容
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁 四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
(1)下列说法一定正确的是
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
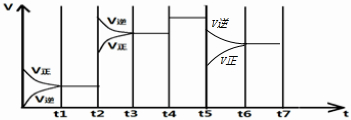
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t2时改变的条件是
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
则各平衡常数间的大小关系为
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
acdh
acdh
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
减小
减小
(填“增大”或“减小”),O2的浓度减小
减小
(填“增大”或“减小”)②假设又向容器中加入一定量的SO3(g),X(SO2)
减小
减小
(填“增大”或“减小”)(3)平衡时,乙容器中SO2的体积分数为
46
46
%(保留两位有效数字),该反应的平衡常数为1.5L?mol-1
1.5L?mol-1
(填具体值和单位,保留两位有效数字)(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t2时改变的条件是
升高温度
升高温度
;②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
K1>K2=K3=K4
K1>K2=K3=K4
(由大到小排列)分析:(1)a、乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,Q2=Q3;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,可逆反应不能完全反应,故2Q2<Q1.
b、乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,但小于乙中的2倍,放出热量39.4kJ,参加反应的二氧化硫为
×0.2mol=0.4mol,故二氧化硫的转化率为
×100%=40%.
c、甲与丁相比,二者为等效平衡,平衡时二氧化硫的物质的量相同,故甲中反应生成的二氧化硫比丁中多.
d、甲与丁为等效平衡,平衡时三氧化硫的质量相同,乙、丙建立等效平衡,平衡时三氧化硫的质量相同;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,转化率增大,平衡时甲容器内三氧化硫的物质的量大于乙容器内三氧化硫的二倍.
e、甲与丁为等效平衡,平衡时对应各组分的物质的量物质的量相同,总的物质的量相同,压强相同;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,转化率增大,平衡时甲容器内总的物质的量小于乙容器内总的物质的量的二倍.
f、甲、乙、丙中起始c(SO2)与c(O2)之比为2:1,反应按2:1进行,任何时刻c(SO2)与c(O2)之比为2:1.
h、若乙的体积为2L,压强减小,二氧化硫的转化率降低.
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①向容器内加入一定量的SO2气体,平衡向正反应移动,氧气的转化率增大,二氧化硫的转化率减小.则X(SO2);
②向容器中加入一定量的SO3(g),平衡向逆反应移动,二氧化硫的转化率降低.
(3)利用反应热计算参加反应的二氧化硫的物质的量,再利用转化率定义计算.
根据三段式计算各物质的浓度变化量、平衡时各物质的浓度,代入平衡常数表达式计算平衡常数.
(4)①由图可知,t 2时正、逆反应速率都增大,且平衡向逆反应移动,该反应正反应是体积减小的放热反应,故应为升高温度.
②若t5时降低压强,平衡向逆反应移动,t5瞬间正、逆反应速率,正反应速率降低更多.
③根据平衡移动解答K1、K2、K3、K4、K5之间的关系.
t2-t3段,为升高浓度,平衡向逆反应移动,平衡常数降低,即K1>K2;
t4-t5段,平衡不移动,反应速率增大,为使用催化剂,平衡常数不变,即K2=K3.
t5-t6段,降低压强,平衡向逆反应移动,平衡常数不变,即K3=K4.
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,可逆反应不能完全反应,故2Q2<Q1.
b、乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,但小于乙中的2倍,放出热量39.4kJ,参加反应的二氧化硫为
| 39.4kJ |
| 197kJ |
| 0.4mol |
| 1mol |
c、甲与丁相比,二者为等效平衡,平衡时二氧化硫的物质的量相同,故甲中反应生成的二氧化硫比丁中多.
d、甲与丁为等效平衡,平衡时三氧化硫的质量相同,乙、丙建立等效平衡,平衡时三氧化硫的质量相同;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,转化率增大,平衡时甲容器内三氧化硫的物质的量大于乙容器内三氧化硫的二倍.
e、甲与丁为等效平衡,平衡时对应各组分的物质的量物质的量相同,总的物质的量相同,压强相同;
甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,转化率增大,平衡时甲容器内总的物质的量小于乙容器内总的物质的量的二倍.
f、甲、乙、丙中起始c(SO2)与c(O2)之比为2:1,反应按2:1进行,任何时刻c(SO2)与c(O2)之比为2:1.
h、若乙的体积为2L,压强减小,二氧化硫的转化率降低.
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①向容器内加入一定量的SO2气体,平衡向正反应移动,氧气的转化率增大,二氧化硫的转化率减小.则X(SO2);
②向容器中加入一定量的SO3(g),平衡向逆反应移动,二氧化硫的转化率降低.
(3)利用反应热计算参加反应的二氧化硫的物质的量,再利用转化率定义计算.
根据三段式计算各物质的浓度变化量、平衡时各物质的浓度,代入平衡常数表达式计算平衡常数.
(4)①由图可知,t 2时正、逆反应速率都增大,且平衡向逆反应移动,该反应正反应是体积减小的放热反应,故应为升高温度.
②若t5时降低压强,平衡向逆反应移动,t5瞬间正、逆反应速率,正反应速率降低更多.
③根据平衡移动解答K1、K2、K3、K4、K5之间的关系.
t2-t3段,为升高浓度,平衡向逆反应移动,平衡常数降低,即K1>K2;
t4-t5段,平衡不移动,反应速率增大,为使用催化剂,平衡常数不变,即K2=K3.
t5-t6段,降低压强,平衡向逆反应移动,平衡常数不变,即K3=K4.
解答:解:(1)a、乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,故Q2=Q3;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,可逆反应不能完全反应,故2Q2<Q1,故2Q2<Q1<197kJ,即2Q3=2Q2<Q1<197kJ,故a正确;
b、乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,故X3=X2;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,但小于乙中的2倍,放出热量39.4kJ,参加反应的二氧化硫为
×0.2mol=0.4mol,故二氧化硫的转化率为
×100%=40%,故X1<2X3=2X2<100%,故b错误;
c、甲与丁相比,二者为等效平衡,平衡时二氧化硫的物质的量相同,故甲中反应生成的二氧化硫比丁中多,二氧化硫转化率甲中较大,故Q1>Q4 且 X1>X4,故c正确;
d、甲与丁为等效平衡,平衡时三氧化硫的质量相同,故m甲=m丁;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,平衡时甲容器内三氧化硫的物质的量大于乙容器内三氧化硫的二倍,所以m甲>2m乙,故m甲=m丁>2m乙,故d正确;
e、甲与丁为等效平衡,平衡时对应各组分的物质的量物质的量相同,总的物质的量相同,压强相同,故p甲=p丁;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,平衡时甲容器内总的物质的量小于乙容器内总的物质的量的二倍,即p甲<2p乙,故p甲=p丁<2p乙,故e错误;
f、甲、乙、丙中起始c(SO2)与c(O2)之比为2:1,反应按2:1进行,任何时刻c(SO2)与c(O2)之比为2:1,故c(SO2)与c(O2)之比k:k甲=k丙=k乙,故f错误;
h、若乙的体积为2L,压强减小,二氧化硫的转化率降低,则到达平衡时放出的热量小于39.4kJ,故h正确.
故选:acdh;
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①向容器内加入一定量的SO2气体,平衡向正反应移动,二氧化硫的转化率减小,氧气的转化率增大,平衡时浓度小,
故答案为:减小;减小;
②向容器中加入一定量的SO3(g),平衡向逆反应移动,二氧化硫的转化率减小,故答案为:减小;
(3)放出热量39.4kJ,参加反应的二氧化硫为
×0.2mol=0.4mol,
根据三段式计算各物质的浓度变化量、平衡时各物质的浓度
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):1 0.5 0
开始(mol/L):0.4 0.2 0.4
开始(mol/L):0.6 0.3 0.4
所以平衡时二氧化硫的体积分数为
×100%=46%,
平衡常数k=
=1.5L?mol-1,
故答案为:46;1.5L?mol-1;
(4)①由图可知,t 2时正、逆反应速率都增大,且平衡向逆反应移动,该反应正反应是体积减小的放热反应,故应为升高温度,
故答案为:升高温度;
②若t5时降低压强,平衡向逆反应移动,t5瞬间正、逆反应速率,正反应速率降低更多,故t5时降低压强,t-v图象为
 ,
,
故答案为: ;
;
③、t2-t3段,为升高浓度,平衡向逆反应移动,平衡常数降低,即K1>K2;
t4-t5段,平衡不移动,反应速率增大,为使用催化剂,平衡常数不变,即K2=K3,
t5-t6段,降低压强,平衡向逆反应移动,平衡常数不变,即K3=K4,
所以K1>K2=K3=K4,
故答案为:K1>K2=K3=K4.
b、乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响,所以乙、丙建立等效平衡,二氧化硫转化率相同,故X3=X2;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,但小于乙中的2倍,放出热量39.4kJ,参加反应的二氧化硫为
| 39.4kJ |
| 197kJ |
| 0.4mol |
| 1mol |
c、甲与丁相比,二者为等效平衡,平衡时二氧化硫的物质的量相同,故甲中反应生成的二氧化硫比丁中多,二氧化硫转化率甲中较大,故Q1>Q4 且 X1>X4,故c正确;
d、甲与丁为等效平衡,平衡时三氧化硫的质量相同,故m甲=m丁;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,平衡时甲容器内三氧化硫的物质的量大于乙容器内三氧化硫的二倍,所以m甲>2m乙,故m甲=m丁>2m乙,故d正确;
e、甲与丁为等效平衡,平衡时对应各组分的物质的量物质的量相同,总的物质的量相同,压强相同,故p甲=p丁;甲、乙两个容器容积相同,甲中相应物质的物质的量为乙中2倍,压强比乙中高,相对乙平衡而言甲中平衡右移,二氧化硫转化率增大,平衡时甲容器内总的物质的量小于乙容器内总的物质的量的二倍,即p甲<2p乙,故p甲=p丁<2p乙,故e错误;
f、甲、乙、丙中起始c(SO2)与c(O2)之比为2:1,反应按2:1进行,任何时刻c(SO2)与c(O2)之比为2:1,故c(SO2)与c(O2)之比k:k甲=k丙=k乙,故f错误;
h、若乙的体积为2L,压强减小,二氧化硫的转化率降低,则到达平衡时放出的热量小于39.4kJ,故h正确.
故选:acdh;
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①向容器内加入一定量的SO2气体,平衡向正反应移动,二氧化硫的转化率减小,氧气的转化率增大,平衡时浓度小,
故答案为:减小;减小;
②向容器中加入一定量的SO3(g),平衡向逆反应移动,二氧化硫的转化率减小,故答案为:减小;
(3)放出热量39.4kJ,参加反应的二氧化硫为
| 39.4kJ |
| 197kJ |
根据三段式计算各物质的浓度变化量、平衡时各物质的浓度
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):1 0.5 0
开始(mol/L):0.4 0.2 0.4
开始(mol/L):0.6 0.3 0.4
所以平衡时二氧化硫的体积分数为
| 0.6mol |
| 0.6mol+0.3mol+0.4mol |
平衡常数k=
| (0.4mol/L)2 |
| (0.6mol/L)2×0.3mol/L |
故答案为:46;1.5L?mol-1;
(4)①由图可知,t 2时正、逆反应速率都增大,且平衡向逆反应移动,该反应正反应是体积减小的放热反应,故应为升高温度,
故答案为:升高温度;
②若t5时降低压强,平衡向逆反应移动,t5瞬间正、逆反应速率,正反应速率降低更多,故t5时降低压强,t-v图象为
 ,
,故答案为:
 ;
;③、t2-t3段,为升高浓度,平衡向逆反应移动,平衡常数降低,即K1>K2;
t4-t5段,平衡不移动,反应速率增大,为使用催化剂,平衡常数不变,即K2=K3,
t5-t6段,降低压强,平衡向逆反应移动,平衡常数不变,即K3=K4,
所以K1>K2=K3=K4,
故答案为:K1>K2=K3=K4.
点评:本题考查化学平衡移动、化学平衡计算、化学平衡常数等,题量很大,难度很大,需要学生具有良好的心理素质与知识的基础,是对学生知识的综合考查.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
乙醇在一定条件下发生化学反应时,化学键断裂的位置如下所示,则乙醇在催化氧化时,化学键断裂的位置是
[ ]

|
A.②③ |
B.②④ |
|
C.①③ |
D.③④ |
 (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=

